A água usada no abastecimento de comunidades humanas requer padrões de qualidade. Assim, ela não deve apresentar sabor, odor e aparência desagradáveis, bem como não deve conter substâncias nocivas e micro–organismos patogênicos. Substâncias orgâ– nicas, como, por exemplo, os compostos 2–trans–6–cis–nonadienal e 3–cis–hexen–1–ol produzidos por algas, em níveis muito baixos (nanograma.L–1), causam alterações no sabor e odor. Em relação à ocorrência de isomeria nos compostos citados, é correto afi rmar que:
Uma amostra de alumínio metálico de massa 21,6 g é completamente
dissolvida em solução aquosa de ácido clorídrico e o gás
liberado na reação é coletado e colocado em um balão de 25 L, onde
a pressão era de 3,0 atm. Em seguida, o gás é aquecido até 127ºC.
Considerando o gás como ideal, a pressão dentro do balão, em atm,
após ser alcançada a temperatura, é aproximadamente igual a:

Um químico orgânico recebeu em seu laboratório uma amostra de um líquido para ser identifi cada. Os primeiros testes (cromatografi a em camada delgada, ponto de ebulição) mostraram tratar–se de uma substância pura. A amostra apresentou resultado negativo nas reações com permanganato de potássio (um agente oxidante forte) e com o reagente de Tollens (espelho de prata). No entanto, apresentou resultado positivo nos testes com iodofórmio e com 2,4–dinitrofenilhidrazina. A partir dessas informações, o tipo de substância que pode ser o líquido analisado é:
Diariamente, inúmeras situações mostram a infl uência da
temperatura na rapidez com que as reações químicas se processam.
Por exemplo, a efervescência de um comprimido antiácido é
maior em água à temperatura ambiente do que em água gelada.
Os alimentos são colocados na geladeira, pois uma diminuição
da temperatura faz com que a decomposição dos alimentos por
micro–organismos ocorra de forma mais lenta. Em um experimento,
a constante de velocidade (k) para a decomposição de primeira
ordem de um composto em solução foi determinada a várias temperaturas
(T), conforme mostra a tabela a seguir:
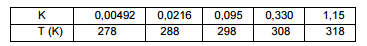
A energia de ativação para a reação de decomposição pode ser
calculada a partir da tabela e seu valor, em kJ.mol–1, é aproximadamente
igual a:
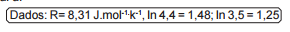
A reação de substituição nucleofílica entre o brometo de tercbutila
e o ânion hidróxido ocorre em um solvente orgânico, em duas
etapas, conforme mostrado a seguir:
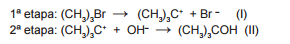
Um perfi l de reação genérico (esboçado) do processo é indicado
no gráfi co que segue:
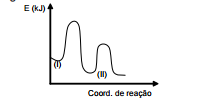
Em função dos dados fornecidos, pode–se afi rmar que o tipo de
substituição nucleofílica e a lei de velocidade da reação são, respectivamente:
Uma suspensão usada como contraste radiológico, à base
de sulfato de bário, foi contaminada acidentalmente com carbonato
de bário, o que pode causar sérios problemas, pois o carbonato se
dissolve no ácido do estômago e os íons bário são extremamente
tóxicos, podendo levar os pacientes à morte, dependendo de sua
concentração na corrente sanguínea. Para determinar o percentual
de carbonato, foram analisados 5,0 g de amostra sólida, constituída
de sulfato e carbonato de bário. Após a reação do sólido com uma
solução aquosa de ácido clorídrico, verifi cou–se a formação de um
gás, que ocupa um volume de 125 mL, a 27ºC e 1atm de pressão.
Considerando o gás como ideal, o percentual de carbonato de bário
na amostra analisada é aproximadamente igual a:

O peróxido de hidrogênio (H2O2) é muito usado em reações
de óxido–redução (ou redox), já que pode atuar como agente
oxidante ou redutor. É vendido comercialmente na forma de soluções aquosas de diferentes concentrações. Em uma análise para
determinar a concentração de uma amostra, 5,10 g de uma água
oxigenada comercial foram diluídos com água até 250 mL. Uma
alíquota de 25 mL da mesma solução foi titulada por uma solução
básica de cloreto de cromo III (CrCl3), conforme a equação não
balanceada abaixo:
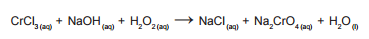
Sabendo que foram gastos 50,00 mL de solução básica de CrCl3
de concentração 0,01 mol.L–1, a porcentagem em massa (% m) de
peróxido de hidrogênio na amostra de água oxigenada é igual a:
As Leis da Termodinâmica explicam as variações de energia e a tendência de ocorrência dos processos de modo espontâneo, sendo essenciais para a compreensão da Química. Considerando, por exemplo, um processo que é exotérmico, em relação à espontaneidade, à variação de entropia (ΔS) e à temperatura, pode–se afirmar que:
Uma amostra de 0,265 g de um antibiótico em pó foi dissolvida
em HCl e completou–se o volume até 100,00 mL de solução.
Uma alíquota de 25,00 mL foi transferida para um balão, seguida
da adição de 25,00 mL de solução aquosa 0,018 mol.L–1 de KBrO3
Um excesso de KBr foi adicionado para formar Br2, segundo a
equação a seguir:
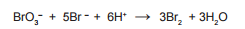
O bromo formado reage com toda a sulfanilamida presente no antibiótico
e, após um tempo, é adicionado excesso de KI, para reagir
com o excesso de bromo, formando Isub>2. Finalmente, o iodo formado é
titulado, consumindo 13,00 mL de uma solução aquosa 0,12 mol.L–1
de tiossulfato de sódio. As demais equações químicas são:
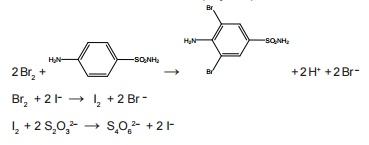
A porcentagem de sulfanilamida presente na amostra do antibiótico
em pó é aproximadamente igual a:

O álcool benzílico (ou fenilmetanol) é um álcool aromático líquido. É utilizado como componente de fragrâncias e aromas, como preservante para produtos oftálmicos, injetáveis e orais, sendo também usado como solvente e como um produto químico intermediário para reações orgânicas. A reação do álcool benzílico com uma solução aquosa básica de permanganato de potássio produz um composto A que, após purifi cação, reage com excesso de etanol, sob catálise ácida, formando um produto orgânico B, também de aplicação industrial, cujo nome é:
A análise elementar quantitativa de 2,035 g de um composto
orgânico oxigenado X forneceu 4,840 g de CO2 e 2,475 g de H2O,
por combustão. Verifi cou–se também que a referida massa de X
ocupa um volume de 1,1275 L, a 227ºC e 1atm de pressão. Dentre
todos os possíveis isômeros, X é o único que possui enantiômeros.
O número total de isômeros (constitucionais e estereoisômeros)
com a fórmula molecular em questão e o nome do composto X
estão respectivamente indicados em:
Considere a sequência de reações mostrada a seguir:
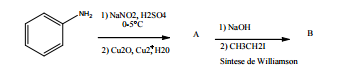
A fórmula estrutural correta do composto B é:
O Modelo Atômico de Bohr foi o primeiro a aplicar o conceito
de quantização da energia e contribuiu decisivamente para a compreensão
da estrutura atômica. Segundo esse modelo, quando um
elétron absorve energia sufi ciente, é promovido a um estado ou
nível eletrônico (n) de maior energia (estado excitado ou ativado).
Ao retornar ao estado fundamental, emite ondas eletromagnéticas
(radiação). Suponha que o elétron do átomo de hidrogênio, no estado
fundamental, absorve energia, sendo promovido para o quarto
nível de energia. O comprimento de onda da radiação emitida pelo
elétron, ao retornar ao estado fundamental, em nanômetros (nm),
é aproximadamente igual a:

Clorobenzeno (C6H5Cl) e bromobenzeno (C6H5Br) formam
soluções ideais. A 100ºC, a pressão de vapor do bromobenzeno
é de 137 mmHg e a do clorobenzeno é de 285 mmHg. Considere
uma solução contendo 30,0% em massa de bromobenzeno em
clorobenzeno a esta temperatura. A pressão de vapor da solução,
em mmHg, é aproximadamente igual a:

A atividade biológica de compostos quirais pode variar muito
de um enantiômero para outro. O caso mais célebre ocorreu com a
talidomida, que causou defeitos congênitos (teratogênese) em fetos
de grávidas que fi zeram uso de medicamentos contendo misturas
de seus isômeros ópticos, cujas estruturas estão indicadas a seguir:
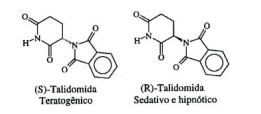
Considere um medicamento que continha um excesso enantiomé–
rico de 50%, em relação ao isômero (R). Pode–se afi rmar, então,
que a composição percentual da mistura era igual a:

