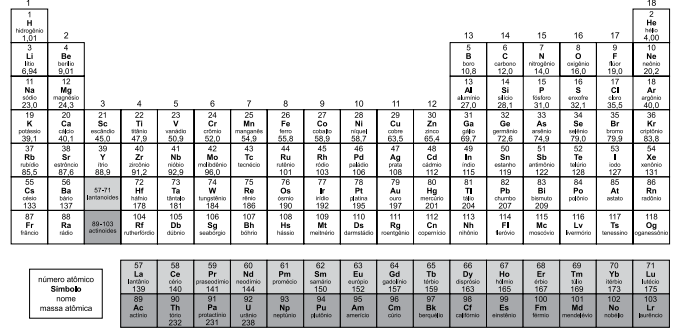
Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
A reação representada pela equação a seguir ocorre em uma única etapa estabelecendo-se equilíbrio entre reagente (R) e produto (P).
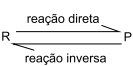
A energia da reação direta é igual a – 100kJ/mol e a energia de ativação da reação direta é igual a 140 kJ/mol. Com a adição de um catalisador, a energia de ativação da reação direta diminui 60 kJ/mol, fazendo com que a energia de ativação da reação inversa seja igual a

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
Um certo metal, M, forma o óxido estável de fórmula unitária MO2 . O cátion Mx+ presente nesse óxido tem configuração eletrônica
Mx+= [Ar] 3d1
O metal M é o elemento

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
Uma reação química nas condições padrão é representada pela equação termoquímica genérica:
Essa reação

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
O composto orgânico de fórmula molecular C12H14O4 é produzido industrialmente a partir da reação representada na equação a seguir.

O reagente X pode participar de uma reação com ácido forte a 140 ºC, resultando em um composto Y, de acordo com a equação
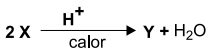
O composto Y resultante dessa reação é um

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
O composto H3BO3 (massa molar = 61,6 g/mol) é um sólido branco cristalino que, ao ser solubilizado em água, forma o ácido bórico, um ácido monoprótico, que em dada temperatura apresenta Ka = 5 x 10–10. Nessa condição de temperatura, usando-se um balão volumétrico de 100 mL e água destilada para se preparar uma solução de ácido bórico com pH = 5,0, a massa de H3BO3 que deve ser pesada é igual a

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
Uma amostra contendo 100 mg de uma mistura de carbonato de cálcio e de óxido de cálcio foi analisada por termogravimetria com aquecimento até 800 ºC em atmosfera de ar. A termogravimetria é uma técnica analítica em que a amostra é aquecida em um forno acoplado a uma balança e a massa da amostra é medida durante o aquecimento. Ao término da análise, o resíduo final apresentou a massa constante de 89 mg.
O teor de carbonato de cálcio na amostra analisada corresponde a:

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
A reação do composto As2S5 sólido com uma solução concentrada de HNO3 resulta na formação do gás NO2, de água e dos íons SO42– e AsO4 3–em solução.
Nessa reação, a participação de 1 mol de As2S5 resulta na formação de___________ de moléculas de água e envolve a participação de___________ de elétrons.
As lacunas são preenchidas, correta e respectivamente, por

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
Para a determinação da concentração de uma solução de ácido sulfúrico, foi transferida com uma pipeta volumétrica uma alíquota de 20 mL dessa solução para um erlenmeyer. Nessa alíquota de solução foram adicionados 100 mL de água destilada e 4 gotas de solução do indicador fenolftaleína.
Foi realizada a titulação da solução contida no erlenmeyer, usando-se uma solução de hidróxido de sódio com concentração 0,110 mol/L. O volume do titulante empregado nessa titulação foi igual a 20,2 mL.
A concentração da solução de ácido sulfúrico correspondeu a

Notas: Os valores de massas atômicas estão apresentados com três algarismos significativos. Não foram atribuídos valores às massas atômicas de elementos artificiais ou que tenham abundância pouco significativa na natureza. Informações adaptadas da tabela IUPAC 2016.
Os compostos representados pelas fórmulas unitárias LiF, CsI, A N e CaO apresentam estrutura cristalina cúbica de face centrada.
N e CaO apresentam estrutura cristalina cúbica de face centrada.

