Leia o fragmento a seguir.
“O objetivo da atividade é evidenciar que esse tipo de
transformação envolve a formação de novas substâncias e que
podem ser acompanhadas de aspectos facilmente perceptíveis ou
evidências.”
(MACHADO, A.H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014)
Em uma das práticas apresentadas pela autora, os alunos
deveriam misturar em um tubo de ensaio três gotas de solução
de nitrato de chumbo II e três gotas de bicromato de potássio.
Ao realizar esse experimento, os alunos deveriam observar
Leia o fragmento a seguir.
“A análise refere-se a um trecho da transcrição de uma aula na
qual um grupo de alunos vai discutir (...) sobre o fenômeno da
queima de uma fita de magnésio. A atividade proposta (...) inclui
a realização de cinco testes que correspondem a transformações
químicas que são acompanhadas por diferentes evidências.”
(MACHADO, A. H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014)
Na prática citada com uma fita de magnésio, os alunos
observariam as seguintes evidências de transformações químicas:
I. a liberação de energia luminosa.
II. a formação de um sólido branco.
III. a necessidade de aquecimento.
Está correto o que se afirma em
Observe a imagem a seguir.

Na conversa entre a mulher e o vendedor são citados dois grupos
denominados genericamente de “agrotóxicos" e “plásticos".
Sobre esses grupos, é correto afirmar que
“Em 1868, Mendeleiev estava debruçado sobre o problema dos
elementos químicos. Eles eram o alfabeto de que a língua do
universo se compunha.”
(STRATHERN, P. O sonho de Mendeleiev.
A verdadeira história da química. 2002, Zahar, p. 11).
Com relação à Tabela Periódica proposta por Mendeleiev, analise
as afirmativas a seguir.
I. Organizou a tabela em função dos números atômicos dos
elementos.
II. Propôs seu nome para um elemento que ainda não havia sido
descoberto, o Mendelévio.
III. Deixou lacunas na Tabela quando parecia que o elemento
correspondente não tinha sido descoberto.
Assinale:
Os ciclos biogeoquímicos contribuem para a troca de matéria e
energia entre a hidrosfera, a atmosfera e a litosfera.
O ciclo hidrológico está relacionado à distribuição da energia
solar assim como as propriedades da água estão relacionadas às
seguintes funções:
I. ao transporte de nutrientes no meio aquoso.
II. à alta solubilização de espécies iônicas.
III. à flutuação do gelo e à circulação vertical de nutrientes na
coluna d’água.
IV. à estabilização da temperatura da biota.
A água realiza essas funções graças às seguintes propriedades:
O nitrogênio amoniacal é um parâmetro relevante para avaliação
da qualidade da água e pode ser determinado pelo método de
Kjeldahl.
Utilizando esse método, todo o nitrogênio de uma amostra de
um efluente foi adequadamente transformado em amônia que
foi recolhida em solução de ácido bórico. Posteriormente o
borato formado foi titulado, consumindo 24 mL de solução
padrão de ácido sulfúrico 0,5 mol.L-1.
A massa de nitrogênio (em mg) presente na amostra, é
aproximadamente igual a
Dados: Massa molares (g.mol-1) H3BO3 = 62, H2SO4 = 98, NH3 = 17 e N =14
No estudo dos modelos atômicos, a hipótese atômica de John
Dalton (1766-1844) é trazida para sala de aula dando base à
discussão sobre a constituição da matéria.
Para o desenvolvimento do trabalho sobre o modelo de Dalton é
importante a discussão sobre
Leia o fragmento a seguir.
“Os conteúdos químicos de natureza simbólica estão agrupados
no nível representacional, que compreende informações inerentes
à linguagem química, como fórmulas e equações químicas. O
aspecto representacional inclui ferramentas simbólicas para
representar a compreensão dos processos de idas e vindas entre
teoria e experimento. (...) Nas análises do momento discursivo
que denominei Elaborando uma Forma Química de Pensar, a
questão dessa dimensão constitutiva da linguagem química
adquire visibilidade.”
(MACHADO, A.H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014)
Sobre as concepções estabelecidas pela autora sobre o momento
discursivo, analise as afirmativas a seguir.
I. Para entender as equações químicas os alunos devem
aprender uma série de conceitos.
II. A equação química e a linguagem química são instrumentos
para a elaboração do pensamento químico.
III. A partir da linguagem química, no movimento de significação
das representações vai se constituindo certa forma de
pensamento.
Assinale:
Sobre a poluição dos recursos hídricos, o excesso de matéria orgânica aportada nos sedimentos do rio provoca a morte de peixes, devido à(ao)
Leia o fragmento a seguir.
“Os alquimistas do século XIV tornaram-se os primeiros a
compreender a natureza dos ácidos. O único ácido conhecido
pelos antigos fora o ácido acético fraco do vinagre. No século VIII,
Djabir havia preparado uma solução fraca de ácido nítrico e
outros alquimistas árabes descobriram que a destilação do
vinagre produzia um ácido acético mais forte. Mesmo o ácido
acético forte, porém, pouco tinha de corrosivo. Não parecia ser
dotado de muito poder reagente.”
(STRATHERN, P. O sonho de Mendeleiev.
A verdadeira história da química. 2002, Zahar, p. 57).
Com relação aos ácidos, assinale V para a afirmativa verdadeira e
F para a falsa.
( ) O ácido acético pode ser classificado como forte ou fraco
dependendo do valor do seu Ka, o que explica as observações
obtidas pelos alquimistas.
( ) O ácido nítrico é um ácido fraco, o que corresponde ao
observado experimentalmente pelos alquimistas.
( ) Tanto o ácido acético como o ácido nítrico são ácidos fortes,
porém os alquimistas não tinham informações suficientes
para classificá-los corretamente.
As afirmativas são, respectivamente,
Na figura a seguir estão representados, de modo resumido, os
níveis de conhecimento químico e suas possíveis relações.
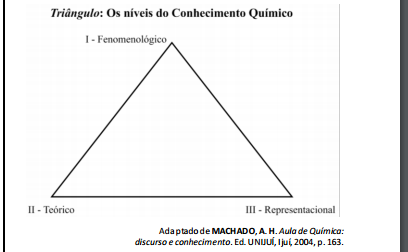
Na figura acima, I, II e III, correspondem, respectivamente,
A atmosfera terrestre é formada por diversos compostos que
podem sofrer transformações químicas cujas velocidades
dependem de fatores tais como: concentração, temperatura,
catalisador e reatividade.
Alguns autores relacionam a capacidade de reagir e de atuar em
diferentes pontos da superfície terrestre como tempo de
residência. O quadro a seguir apresenta o tempo de residência de
alguns constituintes da atmosfera.
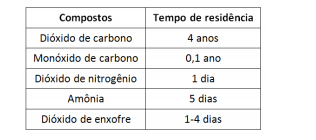
Considerando a hipótese desses compostos serem emitidos nas
mesmas condições e quantidades, e na mesma região geográfica,
assinale a opção que indica o composto que apresenta maior
capacidade de se espalhar pela atmosfera e atuar em regiões
mais distantes.
Leia o fragmento a seguir.
“A Química como ciência tem um campo de sentidos histórico,
cultural e discursivamente construído. Segundo Candela (1995),
os estudos etnográficos que vêm sendo realizados pelos
pesquisadores em Sociologia do Conhecimento Científico têm
considerado que, para os cientistas, a ciência realiza-se nas
práticas discursivas cotidianas e é uma reflexão e um debate
sobre alternativas explicativas.”
(MACHADO, A.H. Aula de Química: discurso e conhecimento.
Ed. UNIJUÍ, Ijuí, 3ª ed., 2014)
Entendendo a ciência como discurso, segundo Machado, é
possível considerar que
I. a ciência é uma construção social que envolve versões
diferentes sobre os temas abordados.
II. a linguagem científica pode possibilitar aos sujeitos uma
maneira de pensar/falar sobre o mundo.
III. a linguagem científica possui características próprias como
forma de registrar e ampliar o conhecimento científico.
Está correto o que se afirma em
No estudo de Termoquímica, o professor propôs uma experiência
para determinação do calor de combustão do álcool etílico
(etanol).
O procedimento experimental e as anotações de um grupo de
alunos estão apresentados a seguir:
I. preparar a lamparina colocando uma quantidade suficiente
de álcool etílico para que a combustão possa ser realizada.
II. determinar a massa do sistema “álcool-lamparina” (mi) e
anotar no caderno. Valor anotado mi= 180,0 g;
III. determinar a massa do erlenmeyer (me) vazio e anotar no
caderno. Valor anotado me = 200,0 g;
IV. medir 100 mL de água, que correspondem a 100 g, em uma
proveta e transferir para o erlenmeyer. Envolver as paredes
do erlenmeyer com jornal e prender com fita crepe. Colocar
em um suporte;
V. medir a temperatura da água (Ti) e anotar o valor.
Valor anotado Ti = 25°C;
VI. acender a lamparina e aquecer a água do erlenmeyer,
durante 5 minutos. Após esse tempo, apagar a lamparina e
medir a temperatura da água (Tf) e anotar o valor. Valor
anotado Tf = 40°C;
VII. Medir, após algum tempo, a massa do sistema
“álcool-lamparina”(mf) após a combustão. Valor anotado
mf = 160,0 g.
Utilizando os dados anotados e a constante 1,0 cal.g–1.°C–1 como
calor específico da água e a constante 0,2 cal.g–1.°C–1 como calor
específico do vidro, os alunos devem chegar a um valor para o
calor de combustão do álcool, em cal.g–1, de
Leia o fragmento a seguir.
“De acordo com a perspectiva _____, a aula de química é um
espaço de _____ do pensamento químico e de (re)elaboração de
_____.”
Assinale a opção que completa corretamente as lacunas do
fragmento acima.

