A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O hélio é o único gás nobre que não tem 8 elétrons em sua camada de valência.
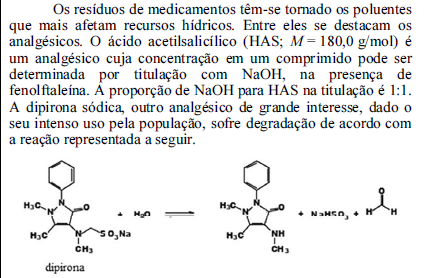
Com base nessas informações, julgue o próximo item.
A função da fenolftaleína nessa titulação é tamponar a solução.

Com base nessas informações, julgue o próximo item.
Se a taxa de produção de oxigênio (d[O2]/dt) for igual a 3,0 × 10−5 mol/s, a taxa de consumo de ozônio (d[O3]/dt) será igual a −2,0 × 10−5 mol/s.
O ibuprofeno (M = 206 g/mol) é um analgésico e anti-inflamatório produzido a partir do ácido 3-fenilpropanoico. Em relação ao ibuprofeno e seu precursor, julgue o item a seguir.
A reação do ácido 3-fenil propanoico com álcool forma um éster.
Acerca das abordagens metodológicas na construção do conhecimento no ensino de química e dos recursos didáticos voltados a esse ensino, julgue o item a seguir.
Para que as atividades experimentais de química tenham sucesso, é fundamental que a escola detenha espaço físico e condições materiais adequadas para a execução dessas atividades, como um laboratório dotado de diversas substâncias químicas puras e equipamentos adequados para a realização dos experimentos, tais como vidrarias, materiais plásticos, porcelanas, ferragens, balança, estufa, banho-maria e placa de agitação magnética com aquecimento, entre outros.
Acerca das abordagens metodológicas na construção do conhecimento no ensino de química e dos recursos didáticos voltados a esse ensino, julgue o item a seguir.
No ensino de química, é sempre recomendável a abordagem da aula expositiva, preferencialmente utilizando-se recursos tecnológicos, como apresentações com projetores.
No que se refere a conceitos básicos de técnicas, materiais e normas de segurança laboratoriais, julgue o item subsequente.
Para se diluir ácidos concentrados, deve-se adicionar a água ao ácido lentamente e sob agitação.
No que diz respeito à relação professor-estudante no ambiente educativo, julgue o item subsecutivo.
A função docente requer um distanciamento emocional que garanta a autoridade do professor no contexto da sala de aula.

A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A adição de sal light à água, para o preparo de macarrão, diminui a temperatura de ebulição e aumenta a pressão máxima de vapor d’água, por isso ela ferveria mais rápido nessas condições.

Considerando o assunto do texto precedente, julgue o item que se segue.
A transformação de metais citada no texto assemelha-se à atual transmutação dos elementos, como, por exemplo, aquela que ocorre na síntese dos elementos com número atômico maior que o do urânio na tabela periódica.
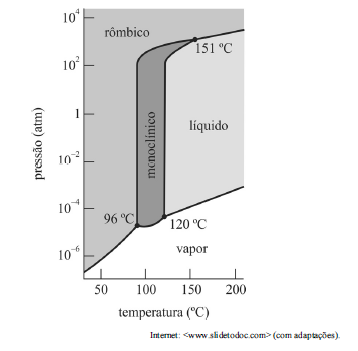
Com referência ao diagrama anterior, que apresenta as fases mais estáveis em pressões e temperaturas diferentes para o enxofre, julgue o item a seguir.
As três fases do enxofre podem coexistir nas temperaturas de 96 °C, 120 °C e 151 °C.
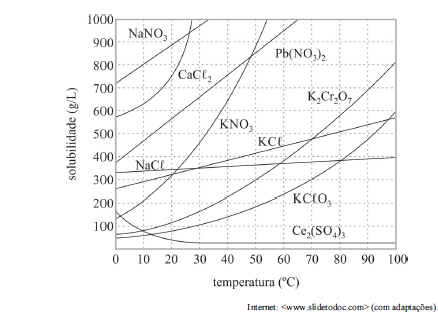
Com base no gráfico precedente, que apresenta as solubilidades em água de algumas substâncias, e considerando que as massas molares do NaNO3 e do KCl valham, respectivamente, 85,00 g/mol e 74,6 g/mol, julgue o próximo item.
A 50 °C, uma solução de 100 mL que contém 80 g de KNO3 é classificada como insaturada.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
Na tabela periódica moderna, não é utilizada a classificação semimetais.
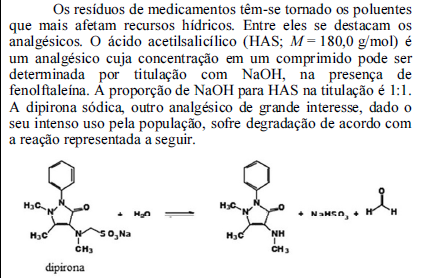
Com base nessas informações, julgue o próximo item.
Considerando-se que 500 mg de comprimido de HAS tenham sido dissolvidos em água e que a titulação desse ácido com NaOH 0,100 mol/L tenha gasto 25,00 mL, é correto concluir que a porcentagem de HAS no comprimido é superior a 91%.
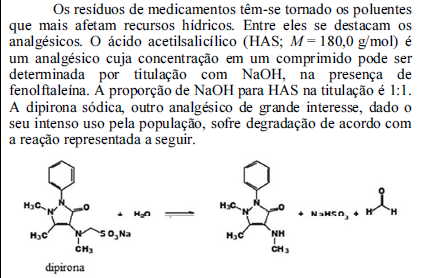
Com base nessas informações, julgue o próximo item.
Nessa reação, a dipirona atua como uma base de Brønsted-Lowry.

