
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
O cloreto de sódio é um composto iônico de estrutura cúbica de face centrada, com número de coordenação igual a 6 para cada íon.
Para a eliminação completa de 16 mg de metanfetamina do corpo, serão formados mais de 40 mg de gás carbônico, considerando-se um rendimento de 80% desse processo.
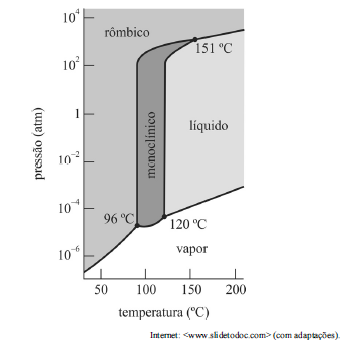
Com referência ao diagrama anterior, que apresenta as fases mais estáveis em pressões e temperaturas diferentes para o enxofre, julgue o item a seguir.
Quando submetido à pressão de 1 atm e à temperatura de 170 °C, o enxofre está na fase sólida.
A respeito da tabela periódica e dos modelos atômicos, julgue o item seguinte.
O carbono assume número de oxidação negativo quando ligado a metais fortemente eletropositivos, como no caso do CaC2.
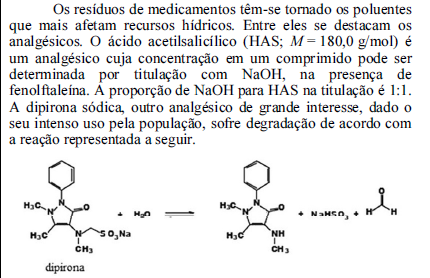
Com base nessas informações, julgue o próximo item.
O NaOH é um óxido básico binário.

Com base nessas informações, julgue o próximo item.
A etapa II do mecanismo proposto, em que a molécula de ozônio reage com o oxigênio atômico, é bimolecular.
O ibuprofeno (M = 206 g/mol) é um analgésico e anti-inflamatório produzido a partir do ácido 3-fenilpropanoico. Em relação ao ibuprofeno e seu precursor, julgue o item a seguir.
Para produzir 25,0 mL de solução aquosa de ibuprofeno com concentração igual a 0,50 mol/L, é necessário usar uma massa inferior a 2,0 g desse medicamento.
Acerca das abordagens metodológicas na construção do conhecimento no ensino de química e dos recursos didáticos voltados a esse ensino, julgue o item a seguir.
Tanto nas atividades teóricas como nas experimentais, é imperativo que o professor resolva os problemas para os alunos e mostre a eles que só existe uma resolução possível para cada problema.
Acerca das abordagens metodológicas na construção do conhecimento no ensino de química e dos recursos didáticos voltados a esse ensino, julgue o item a seguir.
No construtivismo, o professor não é visto como um simples detentor e transmissor do conhecimento, mas principalmente como um mediador que auxilia, dá suporte e estimula os alunos na construção de seus próprios conhecimentos. Os alunos, por sua vez, são vistos como sujeitos ativos nesse processo.
Julgue o item que se segue, relativos à avaliação de aprendizagem aplicada ao conhecimento químico.
Para os teóricos da avaliação de aprendizagem, avaliação e exame são sinônimos.
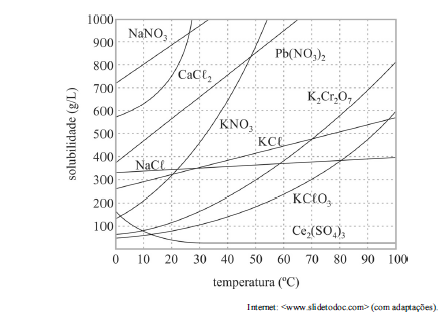
Com base no gráfico precedente, que apresenta as solubilidades em água de algumas substâncias, e considerando que as massas molares do NaNO3 e do KCl valham, respectivamente, 85,00 g/mol e 74,6 g/mol, julgue o próximo item.
Considere-se que uma solução de nitrato de sódio (NaNO3) tenha sido preparada a 20 °C, dissolvendo-se 1,00 mol de NaNO3 em 100 mL de água, e que, posteriormente, esse sistema tenha sido resfriado a 10 °C. Nesse caso, a massa do precipitado formado é superior a 40 g.

A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
Na solução de sal light preparada conforme o texto, estão contidos 1,2 × 1022 íons de Na+.
As moléculas triatômicas participantes da reação supracitada possuem geometria linear.
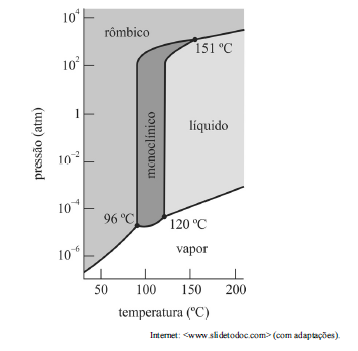
Com referência ao diagrama anterior, que apresenta as fases mais estáveis em pressões e temperaturas diferentes para o enxofre, julgue o item a seguir.
O diagrama de fases do enxofre possui três pontos triplos, mas não é possível observar a existência simultânea de quatro fases.
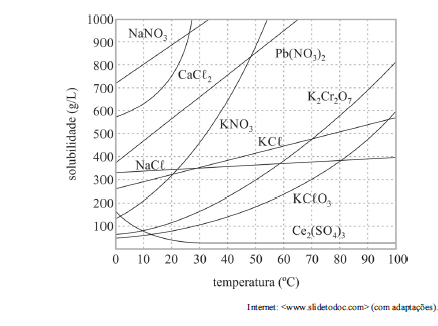
Com base no gráfico precedente, que apresenta as solubilidades em água de algumas substâncias, e considerando que as massas molares do NaNO3 e do KCl valham, respectivamente, 85,00 g/mol e 74,6 g/mol, julgue o próximo item.
Em solução supersaturada, a concentração de soluto é superior à sua solubilidade a uma dada temperatura; mesmo assim, esse soluto permanece dissolvido após aquecimento e lento resfriamento do sistema.



