Na química orgânica também ocorre agrupamento de compostos orgânicos com propriedades químicas semelhantes, em consequência de características comuns. Cada função é caracterizada por um grupo funcional.
Usberco, João; Salvador, Edgard. Química, volume 3: química orgânica. 12.ª ed. reform. São Paulo: Saraiva, 2009.
O butanal pertence à função aldeído, caracterizada pela presença do grupo funcional
As técnicas de cromatografia líquida de alta eficiência (CLAE) e de cromatografia gasosa (GC) são amplamente empregadas para detecção e quantificação de entorpecentes em materiais apreendidos ou em matrizes biológicas.
A figura seguinte representa um cromatograma obtido em uma análise de amostras apreendidas de ecstasy e cocaína, por meio da técnica de CLAE. A identificação dos compostos presentes nas amostras foi realizada por meio da comparação do tempo de retenção dos eluentes com o dos padrões 3,4-MDMA e cocaína, como analitos, e MDA (pico 1), levamisol (pico 2), cafeína (pico 3), benzoielecgonina (pico 4), lidocaína (pico 5), quinina (pico 6) e fenacetina (pico 7), como adulterantes, todos na concentração de 10 µg/mL.
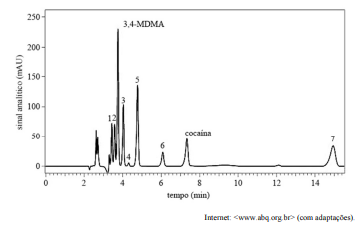
Com base no cromatograma precedente, é correto afirmar que
A Lei de Beer estabelece que a absorvância de uma solução é diretamente proporcional à concentração da espécie absorvente. A fração de luz que passa por uma amostra, chamada de transmitância, está relacionada logaritmicamente com a concentração da amostra. De acordo com a Lei de Beer, a absorvância de uma solução de concentração 0,0048 mol/L, cujo coeficiente de absortividade molar seja igual a 265 L∙mol−1∙cm−1, em uma célula com 0,03 m de caminho óptico, é igual a
Um balão atmosférico a −20°, em determinada pressão, foi preenchido com 2,5x103 mol de gás hélio até completar o volume de 5,0x104 L. Assinale a alternativa que apresenta corretamente o volume molar do gás hélio em −20°C.
Se 2,8 g de Fe3+ forem reduzidos na reação:
Fe3+ + Cu+ → Fe2+ + Cu2+, quantos coulombs (C) de carga devem ser transferidos do Cu+ para o Fe3+ ?
[Dado: Constante Faraday (F) = 96500 C/mol elétron]
Qual das seguintes alternativas apresenta corretamente a reação para a segunda ionização do alumínio?
A seguinte estrutura de Lewis foi desenhada para um elemento (E) do terceiro período da tabela periódica:
Assinale a alternativa que identifica esse elemento (E).
Considere a titulação de uma solução de ácido acético com uma solução de hidróxido de sódio, a 25°C. Com respeito aos estágios dessa titulação, analise as assertivas e assinale a alternativa que aponta a(s) correta(s).
I. Na pré-equivalência, após a adição de um volume de titulante, tem-se uma solução tampão formada pela mistura acetato de sódio e ácido acético.
II. No ponto de meia-equivalência (metade do volume de titulante adicionado), a solução terá pH igual ao valor de Ka (ácido acético).
III. Na equivalência química, a solução resultante terá [OH−] > [H3O+].
Assinale a alternativa que apresenta corretamente a fórmula mínima de um composto que contém as seguintes porcentagens (m/m): 29% Na, 41% S, e 30% O.
De acordo com as seguintes reações descritas de (1) a (4), assinale a alternativa correta.
1. CH4(g) + 2 O2(g) → CO2(g) + 2 H2O(l)
2. CaO(s) + CO2(g) → CaCO3 (s)
3. Mg(s) + 1/2O2(g) → MgO(s)
4. PbCO3(s) → PbO(s) + CO2(g)
A(s) reação(ões) de decomposição é(são):
A velocidade da reação entre o flúor e o dióxido de cloro foi determinada variando as concentrações dos reagentes, de acordo com a reação:
F2(g) + 2 ClO2(g) ⟶ 2 FClO2(g)
Diante das observações experimentais, constatou-se que a lei de velocidade da reação é:
Velocidade = k [F2] [ClO2]
Com base nessas informações, assinale a alternativa INCORRETA.
Atenção: Para responder às questões de números 41 e 42, considere as informações abaixo.
As baleias são os maiores seres vivos do planeta e importantes recicladores de nutrientes dos oceanos. Elas consomem uma quantidade colossal de alimento e suas fezes fertilizam as águas próximas à superfície. Por exemplo, uma baleia azul come cerca de 16 toneladas de peixes, lulas e pequenos crustáceos por dia. Hoje, apenas no oceano Austral, as baleias reciclam por ano, 1 200 toneladas de ferro, nutriente essencial para a reprodução do plâncton, organismos microscópicos que estão na base da cadeia alimentar marinha e contribuem para captar gás carbônico da atmosfera.
(Adaptado de: Revista Pesquisa Fapesp, dez. 2021)
A reação global de captura de gás carbônico pelo plâncton é representada corretamente por:
Um professor demonstrou aos seus alunos o experimento para identificar a natureza das ligações de algumas substâncias. Submeteu a um teste de condução de corrente elétrica alguns materiais no estado sólido e após dissolvê-los em água destilada, como segue.
Frasco I: sal de cozinha.
Frasco II: açúcar.
Frasco III: solução aquosa obtida com o material do frasco I.
Frasco IV: solução aquosa obtida com o material do frasco II.
Frasco V: água destilada com a qual preparou as soluções III e IV.
A condução de corrente elétrica capaz de acender a lâmpada é observada somente no frasco
Na teoria da ligação pela valência, o átomo central em um complexo forma uma ligação covalente coordenada com cada ligante no complexo, sendo os dois elétrons do par envolvido na ligação doados pelo ligante. Nesse caso, o átomo central utiliza um conjunto apropriado de orbitais híbridos formados pela combinação de alguns de seus orbitais (n – 1)d, seu orbital ns, e alguns de seus np. De acordo com essa teoria, a hibridização dos orbitais do íon Fe3+ (Z = 26) que recebem os elétrons dos ligantes, no complexo é
O estudo dos elementos químicos teve grande avanço com a espectroscopia. A invenção do espectroscópio nos anos 1850 garantiu a imortalidade desse químico, porém é mais conhecido por ter seu nome associado a um equipamento de laboratório. Esse personagem da História da Química, de nacionalidade alemã, é

