Preencha as lacunas do seguinte quadro, supondo que cada coluna representa um átomo neutro:
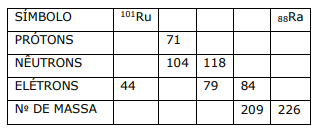
Considerando o quadro acima, assinale a afirmação FALSA.
O principal mineral nos ossos e nos dentes é a hidroxiapatita, Ca 5(PO4)3OH, que contém o íon Ca2+. No estado fundamental, o elemento cálcio, de símbolo Ca, tem número atômico 20. Dessa forma, considerando a posição na tabela periódica dos elementos, o cálcio encontra-se no
A configuração eletrônica do átomo de Flúor que possui Z = 9 e A= 19 é apresentada na alternativa:
Considerando os conceitos de átomo, estados da matéria e reações químicas, julgue os itens seguintes.
A menor partícula que pode existir de um elemento é denominada de átomo, que é uma espécie eletricamente neutra que consiste em um núcleo rodeado de elétrons.
A análise elementar de um composto orgânico resultou em 48,63% de carbono, 43,19% de oxigênio e 8,18% de H. Sabendo-se que o peso molecular desse composto é 222,3 g mol-1, sua fórmula molecular é:
Em um experimento, para determinar a massa atômica de um elemento, foi constatado que a massa determinada era 140 vezes mais pesada do que um átomo de hidrogênio. Sabendo que o número de prótons é igual a 59, determine o número de átomos em um 1 kg de amostra desse elemento:Considere que a massa do próton é igual à massa do nêutron e vale 1,7 x 10-27 kg.
Átomos diferentes que apresentam o mesmo número de nêutrons são chamados:
Compare os íons Ca²+ e S²-, oriundos dos átomos fundamentais dos elementos 20Ca40 e 16S32. Ambos têm em comum o fato de que possuem
Sabendo-se que um átomo possui 10 prótons, 12 nêutrons e 10 elétrons, pode-se afirmar que:
Um pilar de extremidades articuladas tem seção transversal quadrada de 2m de comprimento. Esta coluna é constituída de pinho com E = 13GPa e σadm = 12 Mpa para compressão na direção paralela às fibras. Usando um coeficiente de segurança de 2,5 no cálculo da carga crítica de Euler para flambagem, determinar a dimensão, em mm, da seção transversal, de modo que a coluna possa resistir com segurança a uma força de 100KN.
A carga nuclear consiste no número de prótons do núcleo
atômico e é igual ao número atômico do elemento químico
correspondente. Os nêutrons, também presentes no
núcleo de um átomo, contribuem para a massa atômica,
mas não para a carga nuclear. Desta forma, é correto
afirmar que
I. o átomo de hidrogênio possui 1 próton e 1 nêutron
no seu núcleo.
II. a carga nuclear do átomo de hidrogênio é +1
III. o número atômico do hidrogênio é 1
É correto o que está contido em
Será que todos os átomos de hidrogênio que existem na natureza são exatamente iguais? A reposta é não. A grande maioria dos átomos de hidrogênio pode ser representada por H. Contudo, além deles existem também outros, em menor quantidade, representados por H e H. Qual alternativa traz, respectivamente, a semelhança e a diferença existentes entre eles e o nome deste fenômeno?
Conhecido desde a pré-história, o cobre é utilizado, atualmente, para a produção de materiais condutores de eletricidade e em ligas metálicas como latão e bronze. Na natureza são encontrados dois isótopos estáveis: Cu-63 (69,17%) e Cu-65 (30,83%). Determine a massa atômica do elemento químico cobre.
Considere as seguintes espécies:
Podemos afirmar que:
Considerando as informações do texto acima e sabendo que as massas molares do K e do Cl são, respectivamente, 40 gmol1 e 35 gmol1 , julgue os itens a seguir.
Sabendo-se que o sódio e o cloro estão no mesmo período da Tabela Periódica e que o sódio pertence ao grupo 1 e o cloro, ao grupo 17, é correto concluir que a energia de ionização do cloro é superior à do sódio.


