Para preparar um tacacá saboroso, deve-se adicionar Cloreto de sódio na medida certa ao tucupi. Em sua primeira experiência na cozinha, uma aspirante a tacacazeira adiciona 35,1 g desse sal em 3 L de tucupi, mas percebe que está “muito salgado" e adiciona tucupi até alcançar uma concentração de 0,05 mols de NaCl por L de tucupi. A quantidade de tucupi adicionada foi de
Obs.: Massas molares em g.mol-1: Na = 23 e Cl = 35,5.
Ao adoçar 700 mL de suco de cupuaçu em uma jarra a 35 °C, uma pessoa utiliza 0,8 mols de glicose (C6H12O6), obtendo uma solução saturada sem corpo de fundo. Contudo, depois de ter colocado esta jarra em um refrigerador por duas horas, nota-se o acúmulo de uma certa quantidade de açúcar no fundo da jarra. Considerando que o coeficiente de solubilidade do açúcar no suco de cupuaçu é de 0,15 g/mL, e que as massas atômicas são C=12, H= 1 e O= 16, o número aproximado de mols de glicose não-dissolvidos a 0 °C é de
Uma alíquota de 15 mL de uma solução de Al(OH) 3 foi padronizada utilizando-se 0,15 miliequivalentes-grama de biftalato de potássio (hidrogenoftalato de potássio). Determinada a concentração da solução básica, 22 mL desta solução foram necessários para padronizar uma alíquota de 10 mL de H2SO4. Assim, a massa de H2SO4 presente em 500 mL de solução é de, aproximadamente:
Considerando-se que as massas molares em g.mol -1 são S=32, H= 1 e O= 16, a massa de H 2SO4 presente em 500 mL de solução é de, aproximadamente,
A acidez titulável do leite é expressa em porcentagem (massa/volume) de ácido lático (menor ∝ - hidroxi-ácido carboxílico com isomeria óptica). Uma alíquota de 0,01 L de amostra de leite foi colocada em um erlenmeyer e adicionou-se 2 gotas de fenolftaleína. A titulação da amostra consumiu 1,68 cm3 de solução de NaOH 4,0 g.L-1.
A acidez do leite na amostra, expressa em porcentagem (massa/volume) é, aproximadamente:
O pireno (C16H10) é um hidrocarboneto aromático policíclico, inicialmente empregado na preparação de corantes sintéticos. No preparo de uma solução dessa substância, 0,50 mL de uma solução contendo um grama por litro de hexano foi levada ao volume final de 10 mL, utilizando o mesmo solvente.
A concentração aproximada de pireno nessa solução, expressa em mol.L-1, é
Julgue o item a seguir quanto às reações e aos usos que envolvem o carbonato de cálcio e seus derivados.
Suponha‐se que uma amostra de carbonato de cálcio de massa igual a 100 g seja aquecida até ser decomposta. Nesse caso, considerando‐se a massa molar do carbono igual a 12 g mol−1, a massa molar do oxigênio igual a 16 g mol−1 e a massa molar do cálcio igual a 40 g mol−1, a massa residual de sólido obtido será menor que 46 g.
Qual é a massa, em gramas, de NaCl necessária para precipitar todos os íons prata presentes em 15,0 mL de solução de 0,125 mol L -1 de AgNO3?
(Massas molares (g mol-1): Na = 23; Cl = 35,5; Ag = 108; N = 14; O = 16)
Para extrair substâncias químicas de polaridades distintas em uma amostra aquosa, uma estratégia possível é empregar um modelo de extração liquido-liquido-liquido com dois diferentes solventes extratores utilizados sucessivamente, com o auxílio de um funil de separação. Após a 1ª extração com um solvente extrator, denominado SOLVENTE 1, os dois líquidos imiscíveis foram recolhidos separadamente e denominados FRAÇÃO A (líquido localizado na porção inferior no funil de separação) e FRAÇÃO B (acima da FRAÇÃO A). Em seguida, a Fração B foi submetida a uma nova extração, com um novo solvente extrator, denominado SOLVENTE 2, e apenas o líquido localizado na porção inferior do funil de separação foi recolhido (denominado FRAÇÃO C). A esse respeito, considere as informações descritas na Tabela a seguir, com valores obtidos a 25ºC, e assinale a alternativa correta.

Considere que, para determinar a concentração de uma solução de H
2S, um químico tenha misturado uma alíquota de 20,0 mL dessa solução com 20,0 mL de uma solução-padrão de NaOH (aq) 0,430 mol/L. Após a reação de neutralização, ele determinou o excesso de NaOH na solução resultante por meio da titulação dessa solução com 20,0 mL de uma solução-padrão de HC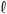
Considerando essas informações e que a viragem do indicador fenolftaleína ocorra na faixa de pH entre 8,2 e 9,8, julgue o item que se segue.
Se, para atingir o ponto de equivalência da titulação descrita, tiverem sido gastos 16,0 mL da solução que contenha o excesso de NaOH, então infere-se que a concentração da solução de H2S é igual a 9,00 × 10-2 mol/L.
A extração líquido-líquido baseia-se na diferença de solubilidade de um soluto em dois líquidos imiscíveis. Portanto, a quantidade do soluto que é extraída depende do seu coeficiente de partição ou coeficiente de distribuição (K) entre as duas fases líquidas. Qual a porcentagem aproximada de um soluto extraído para 100 mL de éter de petróleo, supondo que foram usados 100 mL de fase aquosa contendo 5 g do soluto, após agitação em funil de separação?

Professor Dimitri desenvolveu uma aula de preparo de soluções com seus 30 alunos do curso técnico em agropecuária integrado ao ensino médio. Cada estudante preparou 100 mL de solução de hidróxido de sódio, de concentração 4 g/L. Ao finalizar a aula, o professor solicitou ao técnico que ele neutralizasse a totalidade de soluções preparadas e descartasse-as. Prontamente o laboratorista localizou uma solução de ácido clorídrico 6 mol/L e procedeu à neutralização. Qual o volume necessário para a neutralização ácido-base, admitindo que todos os estudantes tenham conseguido soluções com a concentração pedida?
A respeito de soluções e concentração de soluções, julgue o item a seguir.
O porcentual em massa/volume é geralmente utilizado para indicar a composição de soluções aquosas diluídas de reagentes sólidos. Desse modo, o nitrato de potássio a 5% aquoso normalmente se refere a uma solução preparada pela solubilização de 5 g de KNO3 em água suficiente para perfazer 100 mL de solução.
Para preparar 75 mL de uma solução tampão fosfato de potássio 0,05 mol.L-1 (pH 2,3), serão necessários 450 mg de ácido fosfórico. Qual volume deve ser utilizado de ácido fosfórico a partir de uma apresentação comercial desse ácido com 85% de pureza para o preparo da solução tampão?
(Dados: densidade=1,88 g.cm-3)
Considere que, para determinar a concentração de uma solução de H
2S, um químico tenha misturado uma alíquota de 20,0 mL dessa solução com 20,0 mL de uma solução-padrão de NaOH (aq) 0,430 mol/L. Após a reação de neutralização, ele determinou o excesso de NaOH na solução resultante por meio da titulação dessa solução com 20,0 mL de uma solução-padrão de HC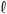
Considerando essas informações e que a viragem do indicador fenolftaleína ocorra na faixa de pH entre 8,2 e 9,8, julgue o item que se segue.
No ponto de viragem da fenolftaleína, durante a titulação que envolve as soluções de NaOH e HC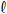
Em um experimento de química, um estudante colocou em um recipiente 500 mL de uma solução aquosa de hidróxido de sódio (NaOH) em uma chapa de aquecimento. O pOH da solução antes do aquecimento era igual a 2. Após um tempo, considerando que se evaporou apenas água, o pOH da solução se reduziu à metade.
Nessas condições, é correto afirmar que o volume, em mililitros, da solução que permaneceu no recipiente ao fim do experimento é igual a

