Industrialmente, o PCl5 é sintetizado em reator fechado por meio da cloração do PCl3, de acordo com a equação química a seguir.
Conforme o princípio de Le Châtelier, o rendimento desse processo pode ser aumentado
Um profissional do Corpo de Bombeiros Militar atua em diversas áreas de proteção e segurança da sociedade. Inicialmente, suas funções eram apenas de contenção e extinção de incêndios. Com o tempo, suas funções foram redefinidas, tornandose um profissional responsável pela preservação do patrimônio ameaçado de destruição, salvamentos e conscientização civil das medidas básicas de segurança. Uma das áreas de atuação do Corpo de Bombeiros Militar é o salvamento em alturas, atividade de grande risco desenvolvida em locais de altitudes. O grande problema em atuar nessas áreas é que o indivíduo pode ficar sujeito a indisposição, dores de cabeça, náusea e cansaço devido ao ar rarefeito.
A equação química a seguir representa um sistema em equilíbrio envolvido na transformação da hemoglobina (Hm) em oxiemoglobina (HmO2) no sangue:
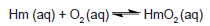
Sobre o processo de transformação de hemoglobina em oxiemoglobina na ação do profissional bombeiro em diferenças de altitudes, assinale a alternativa incorreta.
Um experimento muito usado nas demonstrações de equilíbrio dinâmico é a mistura de NO2 e N2O4 . Este último é um gás que se liquefaz a 21ºC e congela a -11ºC, dímero do primeiro, o monômero. Considere a reação do monômero (2 mol/L) resultando no dímero (1 mol/L) em condições normais de temperatura e pressão e assinale a alternativa que indica o valor correto de Kc nessas condições.

Na esterificação de 1 mol de ácido acético com 1 mol de álcool etílico num recipiente de 1 litro, a 25 °C, o equilíbrio é atingido com constante de equilíbrio igual a 4. Dessa forma, qual a quantidade em mols do éster presente no equilíbrio?
Em um recipiente de 104 mL foram colocados 0,020 mmol de pentacloreto de fósforo submetido a uma temperatura elevada, e então este composto converteu-se ao cloreto de fósforo trivalente após a decomposição térmica. O sistema em questão é reversível e tende ao equilíbrio químico. Atingida esta condição, verificou-se que a concentração do gás formado foi de 0,7 mol/L. Assim sendo, a constante de equilíbrio calculada para este processo será, aproximadamente
O metanol é preparado industrialmente a partir do gás de síntese (CO e H2), de acordo com a seguinte equação:
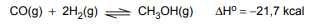
Pelo princípio de Le Châtelier
Ao se comparar o valor de Q (quociente de uma reação química em um dado instante) e K (constante de equilíbrio químico), é correto afirmar que,
Indicador químico é uma substância que muda de cor conforme a acidez do meio em estudo. Considerando a seguinte reação química: HInd + H2O ⇄ H3O+ + Ind–, é correto afirmar que, quando algumas gotas de moléculas de ácidos orgânicos fracos são adicionadas a um meio ácido dessa reação,
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
A adição do catalisador ácido faz que o equilíbrio da reação seja alcançado mais rapidamente; quando alcançado, o equilíbrio estará mais deslocado para o sentido dos produtos.
Sobre a constante de equilíbrio químico (K), é correto afirmar que
O CO2 é constantemente produzido no corpo por processos metabólicos intracelulares. No sangue, o CO2 dissolvido reage com a água, formando ácido carbônico. Rapidamente, o ácido carbônico dissocia-se em íons H+ e HCO3–. No organismo, o tampão bicarbonato constituído pelo par HCO3– e CO2 é o de maior importância fisiológica e envolve de maneira integrada os pulmões, o sangue e os rins. Considerando a ação tamponante desse sistema, que acontece segundo as reações descritas a seguir e a possibilidade de ocorrência de distúrbios do equilíbrio ácido-básico, analise as sentenças abaixo.
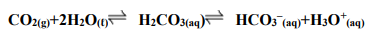
1) Caso ocorra maior produção de ácidos no organismo, decorrente de alguma situação patológica, por exemplo, o equilíbrio será deslocado para a esquerda, com maior produção de CO2 que será eliminado pelos pulmões.
2) Em indivíduos com dificuldades respiratórias e, portanto, maior quantidade de CO2 acumulado no organismo, pode acontecer deslocamento do equilíbrio, com elevação do pH fisiológico.
3) O consumo excessivo de bases, como os medicamentos antiácidos, por exemplo, pode ocasionar deslocamento do equilíbrio, e, em casos extremos, provocar o abaixamento do pH fisiológico.
Está(ão), correta(s), apenas:
O princípio de Le Chatelier diz respeito à resposta de sistemas em equilíbrio quando sujeitos a uma perturbação. De outra forma, o princípio diz que um sistema em equilíbrio, quando perturbado, tende a ajustar-se de modo a remover a perturbação e restabelecer o equilíbrio. Há diversos fatores que podem afetar o equilíbrio de substâncias em uma reação química.
A reação de síntese da amônia estabelece o equilíbrio que pode ser representada pela seguinte equação química:
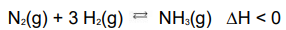
Qual dos fatores NÃO provoca deslocamento nesse equilíbrio químico?
A hidroxiapatita [Ca 5(PO4)3(OH)] é um mineral natural que correspondente a 96% da composição do esmalte dentário, e, na cavidade oral, está susceptível às seguintes reações:

ons fluoreto [F -] (assim como outros elementos) podem ser incorporados durante a formação do esmalte substituindo a hidroxila [OH-], conforme demonstrado a seguir:

Assim, a proteção contra a cárie foi atribuída à substituição da hidroxiapatita pela fluorapatita [Ca5(PO4)3(F)] durante a remineralização do esmalte, uma vez que o derivado com flúor apresenta menor solubilidade que hidroxiapatita. Diante do exposto, assinale a alternativa correta.
De acordo com a equação química abaixo, considerando-se a constante dos gases como 0,082, o valor de Kp (constante de equilíbrio em termos de pressão parcial), quando Kc (constante de equilíbrio em termos de concentração) é igual a 8,5 à 300º C, será

Atente para a seguinte reação reversível em equilíbrio:
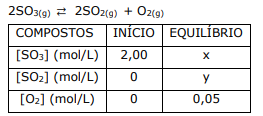
Considerando o quadro acima, é correto afirmar que o valor de Kc para a reação é