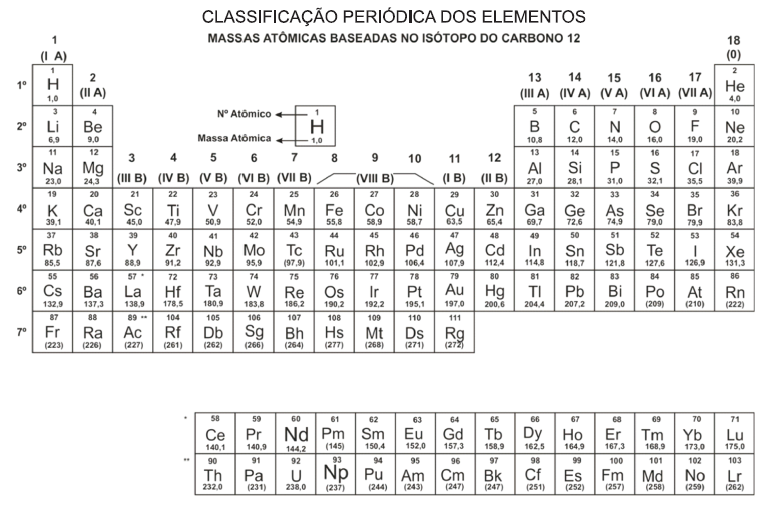
Caso 50 mL de uma solução de Mg(OH)2 0,1 mol/L sejam misturados com 50 mL de Mg(OH)2 0,25 mol/L, então, o volume de HCl 5 mol/L necessário para neutralizar completamente 30 mL dessa nova solução básica será
O metanoato de sódio (HCOONa) é um composto utilizado na indústria para a obtenção do ácido fórmico (HCOOH) por meio de uma reação com ácido sulfúrico (H2SO4). A reação está apresentada abaixo.
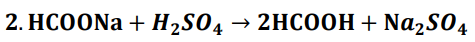
Uma solução aquosa foi preparada a partir da dissolução de 6,8 g de metanoato de sódio em 100 ml de água. Essa solução preparada reagiu com uma solução de ácido sulfúrico com centração de 0,2 mol/L para formação do ácido fórmico. Sabendo que a quantidade de solução de ácido sulfúrico foi a quantidade estequiométrica para completar a reação de síntese, a concentração da solução de metanoato de sódio preparada e a quantidade de solução de ácido sulfúrico adicionada, respectivamente, foram:
Massa molar: Na=23 g/mol; C=12 g/mol; O=16 g/mol; H=1 g/mol.
Reação química causou explosão em paiol no RJ
A explosão no arsenal da Marinha na ilha do Boqueirão (RJ) foi provocada pela combustão espontânea de amostras de pólvora, armazenadas no paiol de trânsito – aquele usado para guardar a munição retirada dos navios. (...) Para entrar em combustão espontânea, a pólvora teve contato com umidade. A umidade provocou reações químicas na pólvora, que pegou fogo e provocou um incêndio. (...) Segundo a Folha apurou, esse é o resultado do laudo que explicará as causas do acidente, ocorrido em 16 de julho passado (...).
https://www1.folha.uol.com.br/fsp/1995/8/25/cotidiano/27.html Acesso em 22/06/2020.
Uma reação que pode ocorrer com a pólvora é
2 KNO3 + S + 3 C → K2S + N2 + 3 CO2
Em uma reação completa, foram obtidos 135 kg de produtos, a partir da queima de 101 kg de nitrato de potássio e 16 kg de enxofre. A quantidade de carvão queimada, em quilogramas, foi de
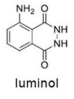
Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
Em 2 mols de moléculas de luminol, existem 14 × 1023 átomos de hidrogênio.
Uma mistura de carbonato de sódio decahidratado e bicarbonato de sódio foi colocada em um cadinho e levada a uma mufla a 350 °C por 3 h, tendo ocorrido as seguintes reações.
Finalizado o processo, restou unicamente carbonato de sódio no cadinho, verificando-se uma perda total de massa de 6,70 g.
Sabendo que M(H) = 1 g/mol, M(C) = 12 g/mol, M(O) = 16 g/mol e M(Na) = 23 g/mol, e supondo que a quantidade de CO2 seco desprendido do cadinho seja igual a 2,20 g, assinale a opção que indica a quantidade, em gramas, de Na2CO3 • 10 H2O existente na mistura inicial.
Em um acidente ocorrido em Ribeirão Preto (SP), um caminhão tombou e provocou o vazamento de 25 litros de ácido nítrico (HNO3). Segundo informações do Corpo de Bombeiros Militar local, um dos compartimentos que transportavam esse produto caiu do caminhão e, ao bater no chão, a tampa se soltou e causou o derramamento do produto. O Corpo de Bombeiros Militar utilizou como reagente neutralizante do produto carbonato de sódio (Na2CO3).
Disponível em: <http://g1.globo.com/sp/ribeirao-preto-franca/noticia/2013/11/caminhao-tomba-e-causa-vazamento-de-acidoem-rodovia-de-ribeirao-preto.html>. Acesso em: out. 2018.[Fragmento adaptado].
Sabe-se que o reagente derramado tem as seguintes características:
1. D ensidade igual a 1,5 g/mL.
2. P ercentual em massa igual a 60%.
Nessas condições, é correto afirmar que a massa de carbonato de sódio, em quilogramas, que reagiu
completamente com o ácido para neutralizá-lo é de, aproximadamente,
Com o avanço crescente da violência nas grandes cidades, o uso de armas não letais pelas polícias e forças armadas, no intuito de dispersar ou controlar multidões em protestos ou manifestações violentas, vem crescendo cada vez mais no Brasil. Entre essas armas, os compostos lacrimogêneos destacam-se como um poderoso agente, provocando irritação nos olhos, acompanhada por lacrimação, assim como irritações na pele e nas vias respiratórias. Os lacrimogêneos são constituídos de três compostos que são utilizados separadamente: o cloroacetofenona (CN), o 2-clorobenilideno malononitrila (CS) e dibenz-1:4-oxazepina (CR).
A seguir estão representadas as estruturas desses três compostos:
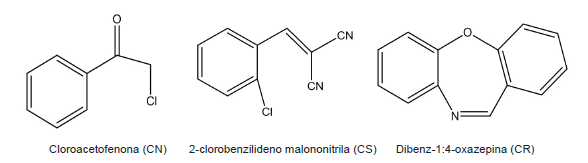
Sobre esses compostos, foram feitas as seguintes afirmativas:
I. Um mol de molécula do composto CN tem 5 pares de elétrons não ligantes.
II. Um mol de molécula do composto CS tem 4 ligações pi.
III. Um mol de molécula do composto CR tem 9 mols de átomos de hidrogênio.
IV. Somente o composto CS tem mais de um carbono primário.
Estão corretas as afirmativas
Uma docente solicitou ao técnico de laboratório que previsse a quantidade, em massa, de limalhas de ferro para seis experimentos a serem realizados em uma aula de Química Geral. A reação pretendida deverá levar à formação de 0,002 mol de cloreto de ferro/experimento, equivalente ao rendimento de 80%, a partir da interação do ferro metálico com ácido clorídrico. Ao final dos cálculos químicos, o técnico apresentou à docente a seguinte quantidade de limalha de ferro para a aula em questão
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
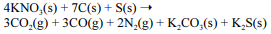
Acerca desse assunto, julgue o próximo item.
A equação apresentada desobedece ao princípio de Lavoisier, uma vez que a massa dos produtos é menor que a massa dos reagentes devido à presença de gases de baixa densidade formados pela reação.
O gás amônia, perigoso aos seres humanos, é de uso comum nas indústrias alimentícias, petroquímicas e metalúrgicas com várias aplicações. Mesmo exigindo o uso adequado de equipamentos de proteção individual e procedimentos de segurança, uma indústria teve o gás amônia recentemente citado em um vazamento de gás que levou centenas de seus funcionários a procurar atendimento médico com sintomas característico de intoxicação. A respeito da produção do gás amônia apresentado na equação a seguir, assinale a alternativa que apresenta o volume do gás NH3 obtido a partir de 12 L de N2(g).
Considere todos os gases nas condições normais de temperatura e pressão (CNTP).
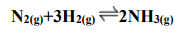
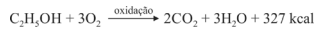
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
A massa de 1 mol de etanol é 46 g
Em condições ideais, pequenas quantidades de gás cloro podem ser geradas em laboratório pela reação do óxido de manganês (MnO2) com ácido clorídrico (HCl), conforme a equação química a seguir não balanceada.
HCl(aq) + MnO2(s) → H2O(L) + MnCl2(s) + Cl2(g)
A partir dessas informações, quantas moléculas de gás cloro, aproximadamente, podem ser produzidas quando 10 g de óxido de manganês com grau de pureza de 87% são colocados para reagir completamente com excesso de ácido clorídrico?
Dado: Número de Avogadro (N) = 6 x 1023
Sabendo-se que a massa molar do ouro (Au) é 197 g mol-1 (gramas por mol), calcule a massa em gramas (g) de 1 átomo desse elemento e assinale a alternativa correta. Utilize o número de Avogadro como sendo 6 x 1023.
As quantidades máximas de oxigênio molecular gasoso e de água líquida que podem ser produzidas na reação de decomposição de 1 litro de uma solução aquosa 0,4 mol.L-1 de peróxido de hidrogênio é:
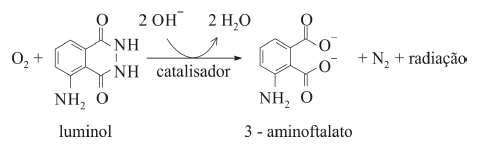
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
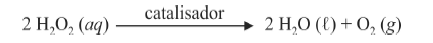
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A massa molar da molécula de luminol é superior a 176,0 g/mol.