De acordo com a seguinte reação N2 + 3H2 → 2NH3 , podemos afirmar que sãonecessários quantos gramas de N2 para a obtenção de 204g de NH3 ? (Massa molarN=14; H=1)
Um técnico de laboratório da CASAN realizará um teste para determinar o teor de nitrato de prata em uma amostra de acordo com a seguinte reação: NaCl + AgNOM3 → AgCl + NaNO3 . Foram consumidos 36g de NaCl nesta reação. Assim, podemos afirmar que a quantidade de nitrato de prata na amostra é (Massa molar NaCl=58,6; AgNO3 = 169,9)
Devido à sua reatividade, o fósforo não é encontrado na forma
elementar na natureza, porém forma parte de numerosos
minerais. A forma alotrópica branca pode ser obtida a partir do
aquecimento do fosfato de cálcio em um forno a 1450°C em
presença de sílica e carbono. O fosfato é reduzido a fósforo, que
se libera na forma de vapor.
2Ca3(PO4)2 + 6 SiO2 +10 C → 6CaSiO3 + 10 CO + P4
O fósforo branco obtido é, então, condensado em água, evitando-
se a presença de ar para que não inflame. O fósforo branco é
extremamente venenoso - uma dose de 52mg pode ser fatal.
A massa de Ca3(PO4)2 que deverá reagir para produção da dose
letal citada no texto é de :
Dados: Massa molar O = 16g.mol–1 P = 31g.mol–1 Ca = 40g.mol–1
Assim como ocorre em outros tipos de absorção de energia, as moléculas, quando absorvem radiação no infravermelho, são excitadas para atingir um estado maior de energia. Nesse processo, as moléculas absorvem as frequências de radiação no infravermelho que equivalem aos(às)
A combustão é uma reação entre uma substância (combustível)
e o oxigênio (O2) (comburente), com liberação de energia
levando à formação de gás carbônico e água. A falta de
oxigênio durante a combustão pode levar à formação de um
produto indesejável como a fuligem (C), que não tem oxigênio
na sua constituição.
A quantidade de calor liberada é menor nos casos de
combustão incompleta. Portanto, além de gerar compostos
nocivos à saúde humana, a combustão incompleta apresenta
uma grande desvantagem econômica, pois com a mesma
quantidade de combustível haverá menor quantidade de
energia gerada.
O calor liberado na combustão completa de metano é de
802 kJ.mol–1 e, nas mesmas condições de temperatura, o calor
liberado na queima incompleta desse composto, produzindo
fuligem é de 408,5 kJ.mol–1.
(Combustão e Energia disponível em
http://www.usp.br/qambiental/combustao_energia.html; Acesso 01/10/2013)
A massa de metano, queimada de maneira incompleta
produzindo fuligem, necessária para produzir a mesma
quantidade de calor que a queima completa de 8 kg de metano é
Dados: Massa molar do H=1 g.mol–1 C = 12g.mol–1
Considere que a abundância de 13C em um 1 mol de uma
amostra de carbono é igual a 0,10%.
Qual é a massa, em g, de CO2 produzida (apenas com o
isótopo 13C) na combustão completa dessa amostra?
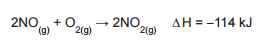
Com base nas informações da equação termoquímica acima
e considerando a reação completa, a energia liberada,
em kJ, na reação de 300 g de óxido nítrico com 6.400 g de
gás oxigênio, para formação de dióxido de nitrogênio é

