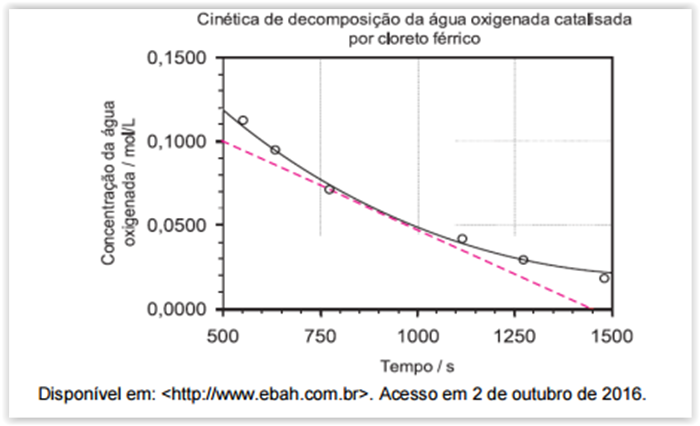
Considere o gráfico a seguir.
O gráfico expressa a cinética de decomposição da água oxigenada catalisada por
cloreto férrico. Por meio desse gráfico, verifica-se que a
Sabendo que o carbono grafite sofre combustão segundo a equação abaixo e que a velocidade de formação do dióxido de carbono é 4 mol/minuto.
C(grafite) + O2(g) CO2(g)
Assinale a alternativa que apresenta a velocidade de consumo do gás oxigênio.
A decomposição do NOCl pode ser descrita pela reação
elementar: 2NOCl(g) → 2NO(g)+Cl2(g).
Sendo a velocidade dessa reação dada em mol.L–1 . s–1, a sua
constante de velocidade será expressa em
Estudos cinéticos da reação 2NO + O2 → 2 NO2 mostraram que quando a concentração inicial de O2 é dobrada e a concentração de NO é mantida constante, a velocidade da reação dobra; quando a concentração inicial de NO é dobrada e a de O2 é mantida constante, a velocidade inicial quadruplica. Qual será o incremento da velocidade inicial da reação quando as concentrações iniciais de O2 e de NO forem triplicadas?
A respeito da constante de velocidade (k ) de uma reação
química, analise as afirmações a seguir.
I - Para processos de primeira ordem, a unidade de k é
mol/L s.
II - O valor de k é exatamente igual ao valor da inclina-
ção do gráfi co que relaciona variação da temperatura
em função do tempo.
III - O valor de k refl ete a efi ciência das colisões efetivas
que geram produtos numa reação química.
É correto APENAS o que se afirma em
Considere a seguinte reação de decomposição do pentóxido de dinitrogênio:

Nesse caso, a lei de velocidade da reação é dada por