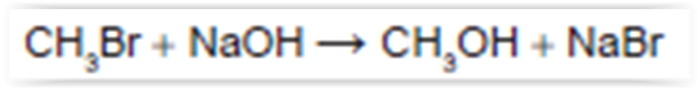Um marceneiro esqueceu um pacote de pregos ao relento, expostos à umidade do ar e à chuva. Com isso, os pregos de ferro, que tinham a massa de 5,6 g cada, acabaram cobertos por uma camada espessa de ferrugem (Fe2O3•H2O), uma substância marrom insolúvel, produto
da oxidação do ferro metálico, que ocorre segundo a equação química:
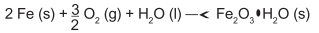
Considere as massas molares (g/mol): H = 1; O = 16; Fe = 56.
Qual foi a massa de ferrugem produzida ao se oxidar a metade (50%) de um prego?
A obtenção de etanol utilizando a cana-de-açúcar envolve a fermentação dos monossacarídeos formadores da sacarose contida no melaço. Um desses formadores é a glicose (C H O ), cuja fermentação produz cerca de 50 g de etanol a partir de 100 g de glicose, conforme a equação química descrita.
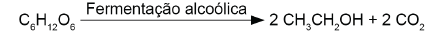
Em uma condição específica de fermentação, obtém-se 80% de conversão em etanol que, após sua purificação, apresenta densidade igual a 0,80 g/mL. O melaço utilizado apresentou 50 kg de monossacarídeos na forma de glicose.
O volume de etanol, em litro, obtido nesse processo é mais próximo de
A obtenção de etanol utilizando a cana-de-açúcar envolve a fermentação dos monossacarídeos formadores da sacarose contida no melaço. Um desses formadores é a glicose (C6H12O6), cuja fermentação produz cerca de 50 g de etanol a partir de 100 g de glicose, conforme a equação química descrita.
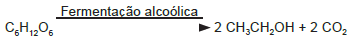
Em uma condição específica de fermentação, obtém-se 80% de conversão em etanol que, após sua purificação, apresenta densidade igual a 0,80 g/mL. O melaço utilizado apresentou 50 kg de monossacarídeos na forma de glicose.
O volume de etanol, em litro, obtido nesse processo é mais próximo de
O volume de etanol, em litro, obtido nesse processo é mais próximo de
As indústrias de cerâmica utilizam argila para produzir artefatos como tijolos e telhas. Uma amostra de argila contém 45% em massa de sílica (SiO2) e 10% em massa de água (H2O). Durante a secagem por aquecimento em uma estufa, somente a umidade é removida.
Após o processo de secagem, o teor de sílica na argila seca será de
Objetos de prata sofrem escurecimento devido à sua reação com enxofre. Estes materiais recuperam seu brilho característico quando envoltos por papel alumínio e mergulhados em um recipiente contendo água quente e sal de cozinha.
A reação não balanceada que ocorre é:

Utilizando o processo descrito, a massa de prata metálica que será regenerada na superfície de um objeto que contém 2,48 g de Ag2S é
Considere o rendimento global de 20% na síntese da atorvastatina cálcica a partir desse éster, na proporção de1:1. Simplificadamente, o processo é ilustrado na figura.
Considerando o processo descrito, a massa, em grama, de atorvastatina cálcica obtida a partir de 100 g do éster é mais próxima de
No Brasil, os postos de combustíveis comercializavam uma gasolina com cerca de 22% de álcool anidro. Na queima de 1 litro desse combustível são liberados cerca de 2 kg de CO2 na atmosfera. o plantio de árvores pode atenuar os efeitos dessa emissão de CO2. A quantidade de carbono fixada por uma árvore corresponde a aproximadamente 50% de sua biomassa seca, e para cada 12 g de carbono fixados, 44 g de CO2 são retirados da atmosfera. No Brasil, o plantio de eucalipto (Eucalyptus grandis) é bem difundido, sendo que após 11 anos essa árvore pode ter a massa de 106 kg, dos quais 29 kg são água.
Uma única árvore de Eucalyptus grandis, com as características descritas, é capaz de fixar a quantidade de CO2 liberada na queima de um volume dessa gasolina mais próximo de
O ácido acetilsalicílico, AAS (massa molar igual a 180 g/mol), é sintetizado a partir da reação do ácido salicílico (massa molar igual a 138 g/mol) com anidrido acético, usando-se ácido sulfúrico como catalisador, conforme a equação química:

Após a síntese, o MS é purificado e o rendimento final é de aproximadamente 50%. Devido às suas propriedades farmacológicas (antitérmico, analgésico, anti-inflamatório e antitrombótico), o MS é utilizado como medicamento na forma de comprimidos, nos quais se emprega tipicamente uma massa de 500 mg dessa substância.
Uma indústria farmacêutica pretende fabricar um lote de 900 mil comprimidos, de acordo com as especificações do texto. Qual é a massa de ácido salicílico, em kg, que deve ser empregada para esse fim?
Climatério é o nome de um estágio no processo de amadurecimento de determinados frutos, caracterizado pelo aumento do nível da respiração celular e do gás etileno (C 2H4,). Como consequência, há o escurecimento do fruto, o que representa a perda de muitas toneladas de alimentos a cada ano.
É possível prolongar a vida de um fruto climatérico pela eliminação do etileno produzido. Na indústria, utiliza-se o permanganato de potássio (KMn0 4 ) para oxidar o etileno a etilenoglicol (HOCH2,CH2,OH), sendo o processo representado de forma simplificada na equação:
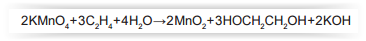
o processo de amadurecimento começa quando a concentração de etileno no ar está em cerca de 1,0 mg de C 2H4 por kg de ar.
As massas molares dos elementos H, C, O, K e Mn são, respectivamente, iguais a 1 g/mol, 12 g/mol, 16 g/mol, 39 g/mol e 55 g/mol.
A fim de diminuir essas perdas, sem desperdício de reagentes, a massa mínima de KMn04 por kg de ar é mais próxima de
A minimização do tempo e custo de uma reação química, bem como o aumento na sua taxa de conversão,
caracterizam a eficiência de um processo químico. Como consequência, produtos podem chegar ao consumidor
mais baratos. Um dos parâmetros que mede a eficiência de uma reação química é o seu rendimento molar (R, em %),
definido como

em que n corresponde ao número de mols. O metanol pode ser obtido pela reação entre brometo de metila e hidróxido de sódio,
conforme a equação química:
As massas molares (em g/mol) desses elementos são: H = 1; C = 12; O = 16; Na = 23; Br = 80.
O rendimento molar da reação, em que 32 g de metanol foram obtidos a partir de 142,5 g de brometo de metila e 80 g de hidróxido de sódio, é
mais próximo de
As emissões de dióxido de carbono (CO2,) por veículos são dependentes da constituição de cada tipo de combustível. Sabe-se que é possível determinar a quantidade emitida de CO2 a partir das massas molares do carbono e do oxigênio, iguais a 12 g/mol e 16 g/mol, respectivamente. Em uma viagem de férias, um indivíduo percorreu 600 km em um veículo que consome um litro de gasolina a cada 15 km de percurso.
Considerando que o conteúdo de carbono em um litro dessa gasolina é igual a 0,6 kg, a massa de CO2 emitida pelo veículo no ambiente, durante a viagem de férias descrita, é igual a
Para cada litro de etanol produzido em uma
indústria de cana-de-açúcar são gerados cerca de 18 L
de vinhaça que é utilizada na irrigação das plantações
de cana-de-açúcar, já que contém teores médios de
nutrientes N, P e K iguais a 357 mg/L, 60 mg/L e 2 034 mg/L,
respectivamente.
SILVA, M. A. S.; GRIEBELER, N. P.; BORGES, L. C. Uso de vinhaça e impactos nas
propriedades do solo e lençol freático. Revista Brasileira de Engenharia
Agrícola e Ambiental, n. 1, 2007 (adaptado).
Na produção de 27 000 L de etanol, a quantidade total
de fósforo, em kg, disponível na vinhaça será mais
próxima de

Considerando que se queira obter 16 mols do metal em
uma reação cujo rendimento é de 80%, a massa, em
gramas, do minério necessária para obtenção do cobre
é igual a
Para proteger estruturas de aço da corrosão, a
indústria utiliza uma técnica chamada galvanização.
Um metal bastante utilizado nesse processo é o zinco,
que pode ser obtido a partir de um minério denominado
esfalerita (ZnS), de pureza 75%. Considere que a
conversão do minério em zinco metálico tem rendimento
de 80% nesta sequência de equações químicas:

Que valor mais próximo de massa de zinco metálico,
em quilogramas, será produzido a partir de 100 kg de
esfalerita.
O bisfenol-A é um composto que serve de matéria-prima para a fabricação de polímeros utilizados em embalagens plásticas de alimentos, em mamadeiras e no revestimento interno de latas. Esse composto está sendo banido em diversos países, incluindo o Brasil, principalmente por ser um mimetizador de estrógenos (hormõnios) que, atuando como tal no organismo, pode causar infertilidade na vida adulta. O bisfenol-A (massa molar igual a 228 g/mol) é preparado pela condensação da propanona (massa molar igual a 58 g/mol) com fenol (massa molar igual a 94 g/mol), em meio ácido, conforme apresentado na equação química.
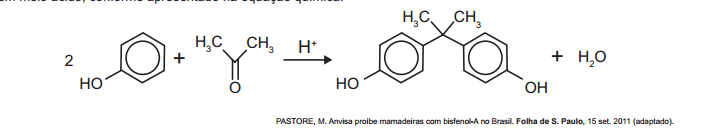
PASTORE, M. Anvisa proíbe mamadeiras com bisfenol-A no Brasil. Folha de S. Paulo, 15 set. 2011 (adaptado).
Considerando que, ao reagir 580 g de propanona com 3 760 g de fenol, obteve-se 1,14 kg de bisfenol-A, de acordo com a reação descrita, o rendimento real do processo foi de