A água potável precisa ser límpida, ou seja, não deve conter partículas em suspensão, tais como terra ou restos de plantas, comuns nas águas de rios e lagoas. A remoção das partículas é feita em estações de tratamento, onde Ca(OH)2 em excesso e Al2(SO4)3 são adicionados em um tanque para formar sulfato de cálcio e hidróxido de alumínio. Esse último se forma como flocos gelatinosos insolúveis em água, que são capazes de agregar partículas em suspensão. Em uma estação de tratamento, cada 10 gramas de hidróxido de alumínio é capaz de carregar 2 gramas de partículas.
Após decantação e filtração, a água límpida é tratada com cloro e distribuída para as residências. As massas molares dos elementos H, O, AI, S e Ca são, respectivamente, 1 g/mol, 16 g/mol, 27 g/mol, 32 g/mol e 40 g/mol.
Considerando que 1 000 litros da água de um rio possuem 45 gramas de partículas em suspensão, a quantidade mínima de Al2(SO4)3 que deve ser utilizada na estação de tratamento de água, capaz de tratar 3 000 litros de água de uma só vez, para garantir que todas as partículas em suspensão sejam precipitadas, é mais próxima de
O cobre, muito utilizado em fios da rede elétrica e com considerável valor de mercado, pode ser encontrado na natureza na forma de calcocita, Cu2S (s), de massa molar 159 g/mol. Por meio da reação Cu2S (s) + 02 (g) -> 2 Cu (s) + S02 (g), é possível obtê-lo na forma metálica. A quantidade de matéria de cobre metálico produzida a partir de uma tonelada de calcocita com 7,95% (m/m) de pureza é
Diesel é uma mistura de hidrocarbonetos que também apresenta enxofre em sua composição. Esse enxofre é um componente indesejável, pois o trióxido de enxofre gerado é um dos grandes causadores da chuva ácida. Nos anos 1980, não havia regulamentação e era utilizado óleo diesel com 13 000 ppm de enxofre. Em 2009, o diesel passou a ter 1 800 ppm de enxofre (S1800) e, em seguida, foi inserido no mercado o diesel S500 (500ppm). Em 2012, foi difundido o diesel S50, com 50 ppm de enxofre em sua composição. Atualmente, é produzido um diesel com teores de enxofre ainda menores.
Os impactos da má qualidade do óleo diesel brasileiro. Disponível em www.cnt.org.br
Acesso em 20 dez.: 2012 (adaptado).
A substituição do diesel usados nos anos 1980 por aquele difundido em 2012 permitiu uma redução percentual de emissão SO3 de
A varfarina é um fármaco que diminui a agregação plaquetária, e por isso é utilizada como anticoagulante, desde que esteja presente no plasma, com uma concentração superior a 1,0 mg/L. Entretanto concentrações plasmáticas superiores a 4,0 mg/L podem desencadear hemorragias. As moléculas desse fármaco ficam retidas no espaço intravascular e dissolvidas exclusivamente no plasma, que representa aproximadamente 60% do sangue em volume. Em um medicamento, a varfarina é administrada por via intravenosa na forma de solução aquosa, com concentração de 3,0 mg/mL. Um individuo adulto, com volume sanguíneo total de 5,0 L, será submetido a um tratamento com solução injetável desse medicamento.
Qual é o máximo volume da solução do medicamento que pode ser administrado a esse individuo, pela via intravenosa, de maneira que não ocorram hemorragias causadas pelo anticoagulante?

Considerando um processo de combustão completa de um gás de cozinha composto exclusivamente por butano (C4H10), a mínima quantidade desse gás que um japonês deve deixar de queimar para atender à meta diária, apenas com esse gesto, é de
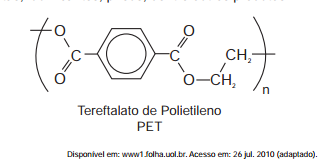
O polímero PET (tereftalato de polietileno), material
presente em diversas embalagens descartáveis, pode
levar centenas de anos para ser degradado e seu
processo de reciclagem requer um grande aporte
energético. Nesse contexto, uma técnica que visa
baratear o processo foi implementada recentemente.
Trata–se do aquecimento de uma mistura de plásticos
em um reator, a 700 °C e 34 atm, que promove a quebra
das ligações químicas entre átomos de hidrogênio
e carbono na cadeia do polímero, produzindo gás
hidrogênio e compostos de carbono que podem ser
transformados em microesferas para serem usadas em
tintas, lubrificantes, pneus, dentre outros produtos.
Considerando o processo de reciclagem do PET, para
tratar 1 000 g desse polímero, com rendimento de 100%,
o volume de gás hidrogênio liberado, nas condições
apresentadas, encontra–se no intervalo entre
Dados: Constante dos gases R = 0,082 L atm/mol K;
Massa molar do monômero do PET = 192 g/mol; Equação
de estado dos gases ideais: PV = nRT
Pesquisadores conseguiram produzir grafita
magnética por um processo inédito em forno com
atmosfera controlada e em temperaturas elevadas.
No forno são colocados grafita comercial em pó e
óxido metálico, tal como CuO. Nessas condições, o
óxido é reduzido e ocorre a oxidação da grafita, com
a introdução de pequenos defeitos, dando origem à
propriedade magnética do material.
VASCONCELOS, Y. Um ímã diferente. Disponível em: http://revistapesquisa.fapesp.br.
Acesso em: 24 fev. 2012 (adaptado).
Considerando o processo descrito com um rendimento de
100%, 8 g de CuO produzirão uma massa de CO2 igual a
Dados: Massa molar em g/mol: C = 12; O = 16; Cu = 64
Três amostras de minérios de ferro de regiões distintas foram analisadas e os resultados, com valores aproximados, estão na tabela:

Considerando que as impurezas são inertes aos compostos envolvidos, as reações de redução do minério de ferro com carvão, de formas simplificadas, são:
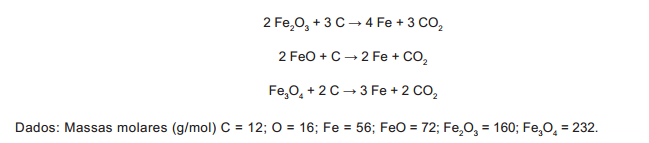
Os minérios que apresentam, respectivamente, a maior pureza e o menor consumo de carvão por tonelada de ferro produzido são os das regiões:
O flúor é usado de forma ampla na prevenção de
cáries. Por reagir com a hidroxiapatita [Ca10(PO4)6(OH)2] presente nos esmaltes dos dentes, o flúor forma a
fluorapatita [Ca10(PO4)6F2], um mineral mais resistente
ao ataque ácido decorrente da ação de bactérias
específicas presentes nos açúcares das placas que
aderem aos dentes.
Disponível em: http://www.odontologia.com.br. Acesso em: 27 jul. 2010 (adaptado).
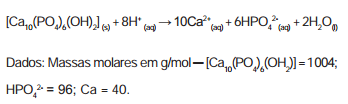
A reação de dissolução da hidroxiapatita é:
Supondo–se que o esmalte dentário seja constituído
exclusivamente por hidroxiapatita, o ataque ácido que
dissolve completamente 1 mg desse material ocasiona
a formação de, aproximadamente,
Fator de emissão (carbon footprint) é um termo utilizado
para expressar a quantidade de gases que contribuem
para o aquecimento global, emitidos por uma fonte
ou processo industrial específico. Pode–se pensar na
quantidade de gases emitidos por uma indústria, uma
cidade ou mesmo por uma pessoa. Para o gás CO2,
a relação pode ser escrita:
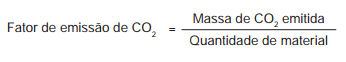
O termo “quantidade de material" pode ser, por exemplo,
a massa de material produzido em uma indústria ou a
quantidade de gasolina consumida por um carro em um
determinado período.
No caso da produção do cimento, o primeiro passo é a
obtenção do óxido de cálcio, a partir do aquecimento do
calcário a altas temperaturas, de acordo com a reação:
CaCO3(s) → CaO(s) + CO2(g)
Uma vez processada essa reação, outros compostos
inorgânicos são adicionados ao óxido de cálcio, tendo o
cimento formado 62% de CaO em sua composição.
Dados: Massas molares em g/mol — CO(s) = 44;
CaCO3 = 100; CaO = 56.
TREPTOW, R. S. Journal of Chemical Education. v. 87 nº 2, fev. 2010 (adaptado).
Considerando as informações apresentadas no texto,
qual é, aproximadamente, o fator de emissão de CO2
quando 1 tonelada de cimento for produzida, levando–se
em consideração apenas a etapa de obtenção do óxido
de cálcio?

Segundo as condições do processo apresentado para a obtenção de carbonato de chumbo (II) por meio da lixiviaçao por carbonato de sódio e considerando uma massa de pasta residual de uma bateria de 6 kg, qual quantidade aproximada, em quilogramas, de PbCO3 é obtida?
Para se obter 1,5 kg do dióxido de urânio puro, matériaprima para a produção de combustível nuclear, é necessário extrair-se e tratar-se 1,0 tonelada de minério. Assim, o rendimento (dado em % em massa) do tratamento do minério até chegar ao dióxido de urânio puro é de
Texto para as questões 17 e 18. Na investigação forense, utiliza-se luminol, uma substância que reage com o ferro presente na hemoglobina do sangue, produzindo luz que permite visualizar locais contaminados com pequenas quantidades de sangue, mesmo em superfícies lavadas. É proposto que, na reação do luminol (I) em meio alcalino, na presença de peróxido de hidrogênio (II) e de um metal de transição (Mn+), forma-se o composto 3-amino ftalato (III) que sofre uma relaxação dando origem ao produto final da reação (IV), com liberação de energia (hν) e de gás nitrogênio (N2). (Adaptado. Química Nova, 25, no 6, 2002. pp. 1003-1011.)
Na análise de uma amostra biológica para análise forense, utilizou-se 54 g de luminol e peróxido de hidrogênio em excesso, obtendo-se um rendimento final de 70%. Sendo assim, a quantidade do produto final (IV) formada na reação foi de
Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico (H2SO4) foram derramadas pelo navio Bahamas no litoral
do Rio Grande do Sul. Para minimizar o impacto ambiental de um desastre desse tipo, é preciso neutralizar a acidez resultante.
Para isso pode-se, por exemplo, lançar calcário, minério rico em carbonato de cálcio (CaCO3), na região atingida.
A equação química que representa a neutralização do H2SO4 por CaCO3, com a proporção aproximada entre as massas
dessas substâncias é:
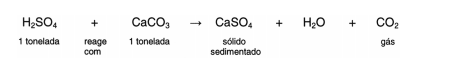
Pode-se avaliar o esforço de mobilização que deveria ser empreendido para enfrentar tal situação, estimando a quantidade de
caminhões necessária para carregar o material neutralizante. Para transportar certo calcário que tem 80% de CaCO3, esse
número de caminhões, cada um com carga de 30 toneladas, seria próximo de
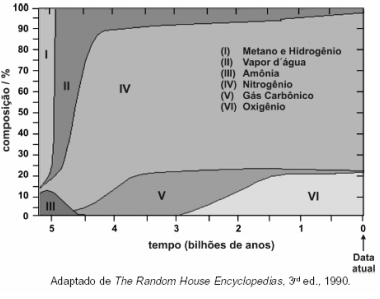
No que se refere à composição em volume da atmosfera terrestre há 2,5 bilhões de anos, pode-se afirmar que o volume de oxigênio, em valores percentuais, era de, aproximadamente,