Sabendo–se que a 20 ºC e pressão atmosférica, a massa de 998,204 kg de água ocupa um volume de 1 m3. Dado que a massa molar da água é igual a 18,02 kg/kmol, para uma vazão volumétrica de 100 m3/h escoando em uma tubulação com área transversal de 0,020 m2, o fluxo molar dessa corrente de água expressoemkmol / (s.m2) será:
Opoder calorífico inferior é aquele em que:
Considerando constante a entalpia de um gás durante a expansão de Joule–Thomson (J–T), o coeficiente de Joule–Thomson pode ser definido como o valor limite da relação (numerador / denominador, nesta ordem) entre:
Para que um sistema se encontre em equilíbrio, o potencial químico deverá:
Considerando água fluindo a 3 g/s por um calorímetro de escoamento. Neste processo são gastos 15 000 Watts de potência térmica para evaporar completamente a água. Sendo desprezíveis as variações de altura e velocidade, e sabendo que a água encontra–se inicialmente a 0 ºC, com a entalpia em estado inicial igual a zero e em seu estado final definido por pressão a 3 bar e temperatura de 300 ºC, sua entalpia do vapor será:
Um reagente é convertido num processo em regime permanente, alimentado por uma corrente de 50 kg/s contendo 80% do reagente em base mássica. Esta corrente é misturada com um reciclo antes de ser alimentada ao reator. A corrente de reciclo corresponde a 80% da saída do reator e a conversão global do processo é de 75%. A porcentagem mássica de reagente na entrada do reator e a conversão do reagente por passe são, respectivamente,
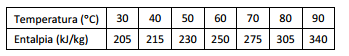
A tabela a seguir apresenta a relação entre a entalpia e a
temperatura de um líquido:
Num processo em regime permanente, duas correntes do mesmo
líquido são misturadas: uma de 20 kg/s a 30C e a outra de
10 kg/s a 90C. Calor é fornecido ao misturador na taxa de
1650 kJ/s e o trabalho de agitação é desprezível.
A temperatura da corrente de saída do misturador é de
A respeito de conceitos de termodinâmica, analise as afirmativas
a seguir.
I.O processo de compressão adiabático reversível é isentálpico.
II.Segundo a equação de estado de gás ideal, se a pressão
exercida sobre um fluido puro dobrar, mantida a temperatura
constante, o seu volume molar dobrará.
III.Para uma substância pura em um sistema fechado, em um
processo com a energia interna constante, as variações de
entropia e volume estão relacionadas pela seguinte relação:
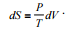
Assinale:
O diagrama a seguir se refere ao método de McCabe‐Thiele
aplicado à destilação do sistema binário etanol‐água à pressão
atmosférica.
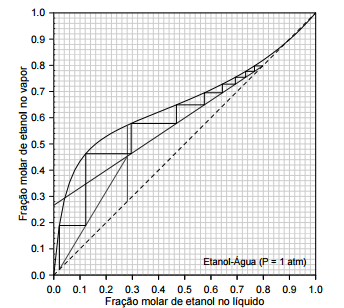
O sistema de destilação é formado por uma coluna de pratos, um
refervedor parcial e um condensador total.
Com base no diagrama, assinale a alternativa que apresenta as
conclusões sobre a fração molar de etanol na corrente de topo
(xD ), a razão de refluxo no topo (R ) e o número de pratos teóricos
na coluna (N ).
Em um equipamento de extração líquido‐líquido, utiliza-se metil
isobutil-cetona (MIC) como solvente para se promover a
separação de uma mistura com 55% de acetona e 45% de água, a
30C e 1 atm. O diagrama a seguir representa o comportamento
do sistema em questão.
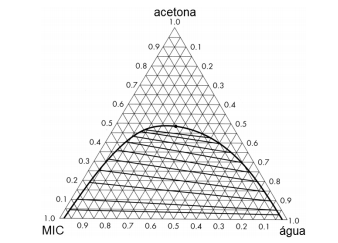
Sabe‐se que as correntes de extrato e rafinado possuem,
respectivamente, 45% e 2% de acetona.
Assinale a alternativa que fornece as melhores estimativas para a
porcentagem de água na corrente de extrato (xágua E) e para a
razão entre a vazão do solvente e a vazão da mistura original
alimentados ao equipamento (S/F).
Observação: todos os dados deste problema estão em base mássica, tal
como as frações representadas no diagrama.
A exploração de óleo no pré‐sal envolve a utilização de equipamentos de processo a profundidades de até 2km de lâmina de água. Admitindo a densidade da água do mar de 1000g/L, a pressão em um equipamento de processo a essa profundidade é de
O número de Nusselt representa, para a camada limite térmica, o que o coeficiente de atrito representa para a camada limite fluidodinâmica. Esse parâmetro de similaridade sugere:
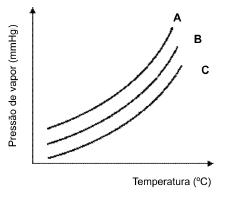
A variação da pressão de vapor, em mmHg, de três
amostras líquidas A, B e C com a temperatura, em ºC,
é mostrada no gráfico que segue.
Analise as afirmativas feitas sobre as amostras.
I. Colocando−se uma gota de cada amostra em
diferentes pontos de um tecido, a amostra A
vaporizará mais rápido.
II. A temperatura de ebulição da amostra B é maior
que da amostra C.
III. As forças intermoleculares na amostra C são,
provavelmente, mais intensas que na amostra A.
IV. Se as amostras forem de água, acetona e álcool,
então pode−se fazer a seguinte associação:
A= água, B= álcool eC= acetona.
V. Se as interações intermoleculares nas amostras
são do mesmo tipo, a molécula da substância da
amostra A é, provavelmente, mais pesada que a
de C.
A alternativa que só contém afirmações verdadeiras
é:
Considerando a lei dos gases ideais, a temperatura máxima que a massa de 19,9 kg de argônio (massa molar = 39,8 kg / kmol) contida em um recipiente de 1 m pode ser aquecida sem que a pressão manométrica exceda 15 kgf/cm2 será: Dado: Cons tante uni ver sal dos gases , R= 8,3 kJ/(kmol*K)
Sobre o segundo princípio da termodinâmica é correto afirmar que: