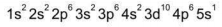Muitas propriedades químicas e físicas dos elementos e das substâncias simples que eles formam variam periodicamente, ou seja, em intervalos regulares em função do aumento (ou da diminuição) dos números atômicos. A respeito das propriedades periódicas dos elementos, assinale a alternativa correta.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
As primeiras propostas de tabela periódica baseavam-se na massa atômica dos elementos como critério de alocação dos elementos ao longo da tabela, o que causava algumas incoerências que, mais tarde, foram sanadas com a adoção do número atômico como critério.

A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
Com exceção do hélio, os gases nobres possuem oito elétrons de valência e, por esse motivo, não são capazes de compartilhar elétrons para formar ligações covalentes.
Atente para o que se afirma a seguir sobre as propriedades periódicas dos elementos químicos:
I. Considerando o segundo período da tabela periódica, é correto afirmar que quanto maior a atração entre núcleo e eletrosfera, menor é o raio atômico.
II. Energia de ionização é igual à energia mínima necessária para “arrancar" um elétron de um átomo isolado em estado gasoso.
III. Em um mesmo período da tabela periódica, como os raios diminuem à medida que se aproximam dos gases nobres, a energia de ionização tende a diminuir nesse mesmo sentido.
IV. Conforme nos deslocamos para baixo da tabela periódica, o raio atômico cresce num mesmo grupo. Os elétrons de valência ficam menos atraídos e a energia de ionização cai.
É correto o que se afirma em
A tabela periódica do químico russo Dimitri Mendeleiev (1834-1907) foi a mais famosa tentativa de colocar os elementos químicos numa classificação ordenada. Nela, o autor ordenou os elementos em ordem crescente de massa atômica e colocava aqueles com propriedades semelhantes numa mesma coluna. A genialidade do químico russo estava em prever que novos elementos seriam descobertos e reservar espaços vazios para eles. As propriedades semelhantes resultam de configurações eletrônicas semelhantes da camada de valência dos elementos.
Acerca das configurações eletrônicas e das propriedades periódicas dos elementos, é INCORRETO afirmar que a
Analisando os elementos abaixo, a opção correta que contém elementos da família dos alcalinos terrosos é:
Existem vários tipos de extintores para uso em diferentes classes de incêndio. Os principais deles são: o extintor de pó químico (NaHCO3), que age por abafamento, interrompendo a combustão; o extintor de gás carbônico (CO2), que age por abafamento e resfriamento; o extintor de água (H2O), que age por resfriamento e, em parte, por abafamento; e o extintor de espuma mecânica, que age por abafamento e por resfriamento.
Com relação ao funcionamento desses tipos de extintores e aos seus componentes químicos, julgue os itens a seguir.
No texto, são apresentadas fórmulas que contêm átomos de elementos químicos de não metal e de um metal de transição.
O elemento químico chamado Rubídio (Rb) apresenta a seguinte configuração eletrônica:
Com base em sua configuração eletrônica, pode-se afirmar que o Rubídio no sistema de classificação periódica dos elementos pertence ao grupo dos:
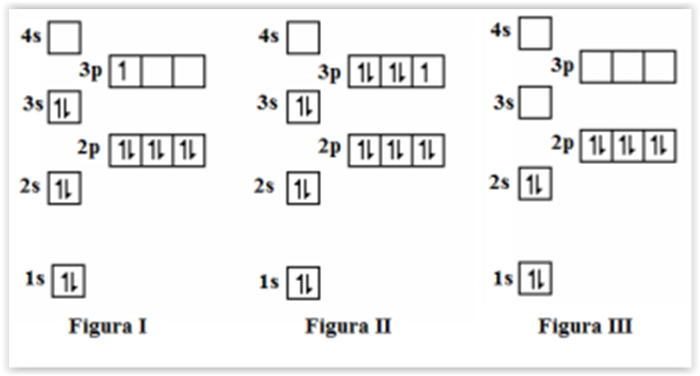
As figuras I, II e III, abaixo, representam as
configurações eletrônicas no estado fundamental de três
espécies químicas denominadas X, Y e Z,
respectivamente:
Com base na distribuição eletrônica apresentada,
assinalar a alternativa CORRETA:
Na determinação de cálcio em águas naturais, a AOAC (Ass°CIation of OfficIal Analytical Chemists/USA) recomenda um
método gravimétrico que consiste em adicionar excesso de ácido oxálico (C2H2O4) a um volume conhecido de amostra e,
em seguida, adicionar a quantidade necessárIa de NH4OH. O precipitado obtido é filtrado, seco, calcinado e pesado, e a
massa de CaO obtida é utilizada para calcular a quantidade de Ca na amostra que, segundo a norma da AOAC, deve ser
expressa como teor de carbonato de cálcio. O método citado é ilustrado pelas equações a seguir. Na análise de uma
amostra de 100,00 mL de água, a massa de CaO obtida foi de 0,2800 g.
Ca+2(aq.) + C2O4-2(aq.) → CaC2O4(s)CaC2O4(s) → CaO(s) + CO + CO2
Dados: Massas molares aproximadas: MM(C2H2O4.2H2O) = 126 g/mol; MM(CaO) = 56 g/mol; MM(CO2) = 44 g/mol, MM(CaCO3) = 100 g/mol;
densidade (H2O) = 1,0 kg/L.
De acordo com os dados apresentados, qual é a concentração de cálcio na amostra de água analisada, expressa em ppm
de CaCO3?
Um cátion trivalente é apresentado na alternativa:
Átomos ou íons que apresentam o mesmo número de elétrons são denominados espécies isoeletrônicas. Nas espécies isoeletrônicas F-, Na+ , Mg2+ e Al3+, o íon
Com relação à classificação periódica e às propriedades
químicas mais importantes dos elementos, julgue os itens
que se seguem.
Os gases nobres são encontrados naturalmente como gases diatômicos não reativos. O gás hélio, por exemplo, é duas vezes mais denso que o ar atmosférico. Pelo fato de não ser inflamável, ele é usado para encher balões e dirigíveis.
Sobre a tabela periódica, em particular sobre energia de ionização, considere as afirmações a seguir:
I. A primeira energia de ionização é maior para os elementos próximos do hélio e menor para os próximos do césio.
II. A segunda energia de ionização é maior do que a primeira energia de ionização do mesmo elemento.
III. Os metais são encontrados à esquerda da tabela periódica porque esses elementos têm baixa energia de ionização e podem perder elétrons facilmente.
IV. Elementos com energias de ionização altas não devem formar cátions facilmente ou conduzir eletricidade.
V. A energia de ionização é a energia necessária para remover um elétron de um átomo na fase gás. De certo modo ela é de fundamental importância para entender como as ligações químicas são formadas e, portanto, sobre as propriedades físicas das moléculas.
Assinale a alternativa correta:
Considerando-se a estrutura interna da matéria e a classificação periódica dos elementos, marcar C para as afirmativas Certas, E para as Erradas e, após, assinalar a alternativa que apresenta a sequência CORRETA: (---) Os íons Na+ e O2- são isoeletrônicos. (---) A energia necessária para retirar um elétron de um átomo na fase gasosa é denominada energia de ionização. (---) No modelo de Rutherford-Bohr, os elétrons apresentam energias e órbitas quantizadas.