O álcool comercial (solução de etanol) é vendido na concentração de 96%, em volume. Entretanto, para que possa ser utilizado como desinfetante, deve-se usar uma solução alcoólica na concentração de 70%, em volume. Suponha que um hospital recebeu como doação um lote de 1 000 litros de álcool comercial a 96%, em volume, e pretende trocá-lo por um lote de álcool desinfetante.
Para que a quantidade total de etanol seja a mesma nos dois lotes, o volume de álcool a 70% fornecido na troca deve ser mais próximo de
No preparo de uma solução, a metodologia geral afirma que o soluto deve ser dissolvido em um pouco de solvente e, a seguir, completado para o volume final em um(a )
A utilização de processos de birremediação de resíduos gerados pela combustão incompleta de compostos orgânicos tem se tornado crescente, visando minimizar a poluição ambiental. Para ocorrência de resíduos de naftaleno, algumas legislações limitam sua concentração em até 30mg/Kg para solo agrícola e 0,14mg/L para água subterrânea. A quantificação desse resíduo foi realizada em diferentes ambientes, utilizando-se amostras de 500 g de solo e 100 mL de água, conforme apresentado no quadro.
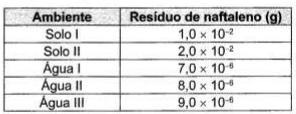
O ambiente que necessita de biorremediação é o(a)
Para o preparo em laboratório de uma solução 4% (massa/volume) de hidróxido de sódio a partir de 50 mL de uma solução 5 mol . L-1
dessa base, é necessário Dados: Massa molar (g.mor-1): Na = 23 0 = 16 H = 1
Um químico preparou, para neutralizar o rejeito de uma reação,
uma solução básica de hidróxido de sódio dissolvendo óxido de
sódio puro em água, em um balão volumétrico de 250 mL. Uma
alíquota de 25 mL desta solução foi transferida para outro balão
volumétrico e diluída com água até 500 mL. A solução resultante
apresentou pH igual a 13.
No preparo da solução básica, a massa de óxido de sódio (em
gramas) dissolvida foi igual a
Dados: Massa molar (g.mol–1): H = 1 O = 16 Na = 23
O uso indiscriminado de compostos orgânicos sintéticos
persistentes e acumulativos e as descargas de agentes
contaminantes têm provocado a degradação de alguns
ecossistemas aquáticos. Alguns desses compostos são
potencialmente cancerígenos e podem provocar efeitos
negativos na reprodução ou no desenvolvimento dos seres
humanos.
O Conselho Nacional do Meio Ambiente estabelece parâmetros
para enquadrar corpos d'água em classes. Cientistas avaliaram as
concentrações de endossulfan e dieldrin em três amostras
distintas de água e compararam com os parâmetros
apresentados na legislação.
Os dados deste estudo estão apresentados na tabela a seguir:
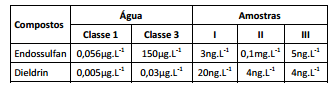
concentrações de endossulfan e dieldrin, são classificadas como
O quadro apresenta o teor de cafeína em diferentes
bebidas comumente consumidas pela população.
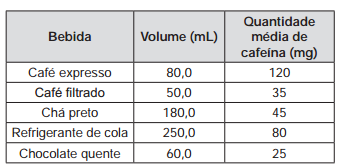
Da análise do quadro conclui–se que o menor teor de
cafeína por unidade de volume está presente no
Sobre uma bancada, há dois frascos: um, com 30,0 mL
de solução aquosa de KOH 0,400 mol L-1 , e outro com
20,0 mL de solução aquosa de NaOH 0,650 mol L-1 . Essas
duas soluções foram transferidas quantitativamente
para um balão volumétrico de 250,00 mL e, em seguida,
acrescentou-se água destilada até o traço de referência.
A concentração de íons OH- , em mol L-1 , na solução resultante
é

O gráfico abaixo indica o grau de solubilidade de uma dada substância em 100 g de água a diferentes temperaturas.
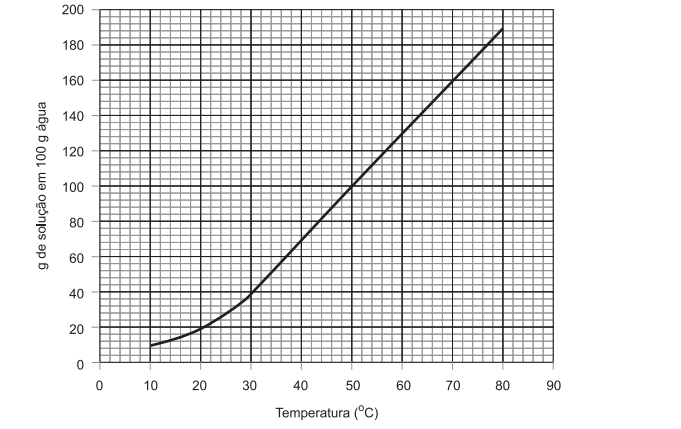
Em um recipiente de vidro, 240 g da substância são solubilizadas em 200 g de água na temperatura de 60 ºC.
A massa da substância, em g, que se deposita no recipiente de vidro quando a solução é resfriada a 50 ºC é
Um técnico dispõe de dois frascos. Um contendo solução de KOH 0,5 mol L-1 e outro contendo solução de NaOH 1,5 mol L-1 . Ele transferiu 40 mL da solução de KOH e 60 mL da solução de NaOH para um cilindro graduado de 1,0 L, acrescentou água destilada até o traço de referência (1,0 L) e, em seguida, homogeneizou bem a mistura.
Com esses procedimentos, ele obteve uma solução final cuja concentração de OH- em quantidade de matéria (mol L-1 ) é
Uma amostra de 15,0 g de bronze (liga metálica de cobre
e estanho) foi completamente dissolvida com ácido nítrico
concentrado, resultando em 1,00 L de solução aquosa.
Um volume de 0,500 L dessa solução foi misturado com
excesso de ferrocianeto de potássio, também em solução,
formando 17,0 g de um precipitado de ferrocianeto de cobre,
conforme a reação apresentada a seguir.
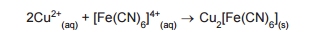
Sabendo-se que o Sn2+ não forma produto sólido com
o íon ferrocianeto, sendo apenas um íon espectador, a
massa de cobre, em g, presente na amostra de bronze é,
aproximadamente
Dados: M(Cu2 [Fe(CN)6 ] (s)) = 339 g mol-1 M(Cu) = 63,5 g mol-1
A quantidade máxima, em g, de hidróxido de chumbo produzida ao se misturar 1.000 mL de uma solução de cloreto de chumbo (PbCl2) 0,10 mol/L e 50 mL de uma solução de hidróxido de sódio (densidade 1,1 g/mL e 11% de NaOH em massa) é, aproximadamente, Dado: Considere a reação completa M(Pb(OH)2) =241 g mol-1
Um técnico recebeu a incumbência de preparar solução aquosa de 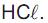 a partir de um frasco de ácido clorídrico recém-adquirido, que traz, em seu rótulo, as seguintes informações: densidade = 1,2 g/cm3 e contém 36,5 % em massa de
a partir de um frasco de ácido clorídrico recém-adquirido, que traz, em seu rótulo, as seguintes informações: densidade = 1,2 g/cm3 e contém 36,5 % em massa de 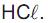
O volume da solução contida no frasco recém-adquirido que deve ser transferido para um cilindro graduado, visando ao preparo de 1,0 L de solução aquosa 0,15 mol L-1 , é
Todos os organismos necessitam de água e grande parte deles vive em rios, lagos e oceanos. Os processos bio - lógicos, como respiração e fotossíntese, exercem profunda influência na química das águas naturais em todo o planeta. O oxigênio é ator dominante na química e na bioquímica da hidrosfera. Devido a sua baixa solubilidade em água (9,0 mg/l a 20ºC) a disponibilidade de oxigênio nos ecossistemas aquáticos estabelece o limite entre a vida aeróbica e anaeróbica. Nesse contexto, um parâmetro chamado Demanda Bioquímica de Oxigênio (DBO) foi definido para medir a quantidade de matéria orgânica presente em um sistema hídrico. A DBO corresponde à massa de O2 em miligramas necessária para realizar a oxidação total do carbono orgânico em um litro de água.
BAIRD, C. Química Ambiental. Ed. Bookman, 2005 (adaptado).
Dados: Massas molares em g/mol: C = 12; H = 1; O = 16.
Suponha que 10 mg de açúcar (fórmula mínima CH2O e massa molar igual a 30 g/mol) são dissolvidos em um litro de água; em quanto a DBO será aumentada?

