O sulfito de sódio (Na2SO3) é um sal inorgânico muito utilizado como conservante de alimentos e na manufatura de papel. Um dos processos de produção do sulfito de sódio pode ser obtido mediante a seguinte equação na condição de equilíbrio químico.

Considerando que para a reação de produção em um processo industrial é desejável que se produza mais sulfito de sódio partindo de um sistema em equilíbrio, qual fator é adequado para tal processo?
Parte do gás carbônico presente na atmosfera é absorvida nos oceanos. Assim, torna-se disponível para as seguintes reações:
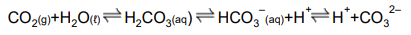
Esse conjunto de reações inclui o sistema de tamponamento das águas oceânicas. Entretanto, o crescente aumento na emissão de gás carbônico, decorrente da queima de combustíveis fósseis, por exemplo, e o consequente aumento de sua captação na água do mar, tem sido associado ao fenômeno de acidificação oceânica. Previsões pessimistas sugerem, em decorrência desse processo, o decréscimo do pH do mar em até 0,4 unidades, até o final do século. Diante do exposto, analise as proposições abaixo.
1) O aumento da concentração de CO2 dissolvido na água do mar desloca o equilíbrio das reações para a direita, com o consequente aumento de íons H+ no meio.
2) A diminuição do pH prevista para o final do século corresponde ao aumento na concentração de íons H+ em torno de 4%.
3) Devido à ação tamponante do sistema carbonato, o aumento do CO2 dissolvido na água do mar implica menor quantidade de íons HCO3– disponíveis para sofrer nova dissociação em H+ + CO32–.
Está(ão) correta(s), apenas:
Analise a equação e as afirmações a seguir, a respeito dos fatores que afetam o equilíbrio de solubilidade e a cinética química das reações. Assinale V para as afirmações verdadeiras, ou F para as falsas.
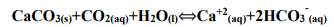
( ) Se a água subterrânea contendo dióxido de carbono (CO2) dissolvido entrar em contato com calcário (CaCO3), à baixa pressão (ex. no interior de uma caverna), mais CaCO3 é dissolvido.
( ) Se a água subterrânea contendo dióxido de carbono (CO2) dissolvido gotejar sobre o calcário (CaCO3), à alta pressão (ex. em regiões de águas profundas), CaCO3 permanece no estado sólido (ex. na forma de estalactites e estalagmites).
( ) Se a água do mar contendo dióxido de carbono (CO2) dissolvido entrar em contato com o calcário (CaCO3), a altas temperaturas (ex. regiões de mar quente), CaCO3 permanece no estado sólido (ex. na forma de corais).
( ) Se a água do mar contendo dióxido de carbono (CO2) dissolvido entrar em contato com o calcário (CaCO3), a baixas temperaturas (ex. regiões de mar frio), mais CaCO3 é dissolvido.
A sequência correta, de cima para baixo, é:
No laboratório de controle de qualidade de uma indústria petroquímica, equivocadamente uma amostra de benzeno puro foi misturada à outra de hexano, também puro. Com o objetivo de determinar a composição molar da mistura, uma pequena amostra foi transferida para recipiente fechado e mantida a 25 ºC até que o equilíbrio líquido-vapor fosse estabelecido. Então, o vapor da mistura foi analisado por cromatografia gasosa, que indicou haver 25 %, em mol, de hexano. Considerando o sistema ideal e que a pressão de vapor do hexano puro é 135 mmHg e do benzeno é 95,1 mmHg, a 25 ºC, assinale a alternativa que contem a porcentagem molar de hexano no líquido em equilíbrio com o vapor a 25 ºC.
Em relação ao equilíbrio químico
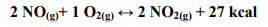
pode-se afirmar:
Considere a equação de equilíbrio a seguir:

Sabe-se que os valores de entalpia padrão de formação (ΔH°f ), em kJ mol -1 à 25 °C são: NH3 = -46, N2 e H2 = 0.
Se a temperatura desse sistema em equilíbrio for aumentada, o equilíbrio será deslocado no sentido de aumentar a concentração
Substâncias no equilíbrio que estejam em fases diferentes dão origem aos equilíbrios heterogêneos. Um exemplo é representado pela equação a seguir:
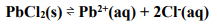
A expressão da constante de equilíbrio que representa a referida equação é:
Considere a reação 2CI
2(g) + 2H2O(g)  4HCI(g) + O2(g) (ΔH = 113 kJ.mol-1) e admita que o sistema está em equilíbrio. O que ocorre ao número de moléculas de H2O no recipiente se:
4HCI(g) + O2(g) (ΔH = 113 kJ.mol-1) e admita que o sistema está em equilíbrio. O que ocorre ao número de moléculas de H2O no recipiente se:
I - For adicionado O2 ?
II - For adicionado Cl2?
III - O volume do recipiente for diminuído?
IV - A temperatura for diminuída?
Assinale a alternativa que responde corretamente as perguntas acima:
A solubilidade molar do AgCl em água a temperatura ambiente é igual a 1,3x10-5 mol L-1. A adição de cloreto de sódio promove um aumento na concentração de íons Cl- na solução. Em decorrência dessa alteração, a solubilidade do AgCl será
Para a reação química 2 CO(g) + O
2(g) 
expressão para a constante de equilíbrio (KC):
A sílica gel utilizada nos dessecadores apresenta coloração azul na forma anidra e rosa na presença de umidade. Este fenômeno pode ser representado na equação a seguir.
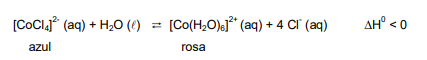
A cor azul pode ser observada quando o sistema em equilíbrio é:

