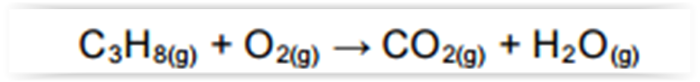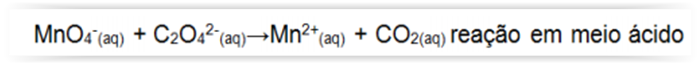Considere as reações I, II e III a seguir.
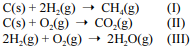
Com relação a essas informações, julgue o item que se segue.
De acordo com a reação I, são necessárias mais de 24 × 1023 moléculas de H2(g) para a formação de 32,0 g de metano.

Considere as reações I, II e III a seguir.
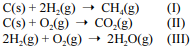
Com relação a essas informações, julgue o item que se segue.
Considere que m1 gramas de H2(g) reajam completamente com 6,0 gramas de C(s), de acordo com a reação I, e que m2 gramas de O2(g) reajam completamente com 6,0 gramas de C(s), de acordo com a reação II. Conforme a lei de Richter, são necessários 2 × m1 gramas de H2(g) para reagir completamente com m2 gramas de O2(g), de acordo com a reação III.
A massa de hidróxido de sódio necessária à preparação de 500 mL de uma solução 0,2 mol/L, é:
Adotar nessa questão, massas atômicas: H = 1, O = 16, Na = 23.
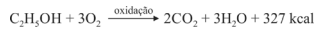
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, a quantidade de O2 consumida é de 48 g.
Qual o volume de gás carbônico, a 27ºC e 1 atm, necessário para que plantas produzam 10 g de glicose, C6H12O6, por fotossíntese na reação
6 CO2(g) + 6 H2O( I ) → C6H12O6(s) + 6 O2(g) ?
Dado: R = 0,082 atm.L.mol-1.K-1.
Na produção de aço é comum reduzir-se o óxido de ferro (III) (Fe2O3) pela adição do elemento carbono (C), na presença de oxigênio e sob condições apropriadas, em uma reação que leva à produção do elemento ferro (Fe) e dióxido de carbono (CO2). Supondo que 0,5 mols de Fe2O3 e 0,3 mols de C são misturados na presença do oxigênio e reagem, assinale a alternativa que apresenta a substância que está em excesso na reação e a massa em excesso desta substância.
(Dados: massas atômicas Fe=55,8; C=12; O=16,0)
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
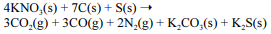
Acerca desse assunto, julgue o próximo item.
Sendo a pólvora formada somente por salitre, enxofre e carvão, na mesma proporção molar da reação apresentada, a queima de 10,0 g de pólvora produzirá mais de 3,0 g de sulfeto de potássio (K2S).
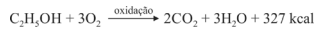
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, são liberados 88 g de CO2.
Considere a combustão completa de dois mols de um dos compostos presentes na gasolina, o octano. Qual a quantidade mínima em mol de gás oxigênio necessária para esse processo?
Se a taxa de formação de gás nitrogênio no enchimento de um airbag é de 156,8 L (nas CNTP) a cada vigésimo de segundo, a taxa de consumo de azoteto de sódio, aproximadamente em mols por segundo, de acordo com a seguinte reação 2NaN3(s) → 2Na(s) + 3N2(g) é
Considere o rendimento global de 20% na síntese da atorvastatina cálcica a partir desse éster, na proporção de1:1. Simplificadamente, o processo é ilustrado na figura.
Considerando o processo descrito, a massa, em grama, de atorvastatina cálcica obtida a partir de 100 g do éster é mais próxima de
Se colocados 100,0 g de Al(s) e 40,0 g de Cr2 O3 em alta temperatura, ocorrerá uma reação de oxidação de alumínio seguindo a reação: 2 Al(s) + Cr2 O3 (s) → Al2 O3 (s) + 2 Cr(l). Identifique qual será o reagente limitante desta reação e quantifique (em gramas) o excesso de reagente que permanece sem reagir. Dados: 1 mol de Al = 27 g Al, 1 mol de Cr2 O3 = 152,0 g Cr2 O3 .
Assinale a alternativa que possui ambas respostas corretas.
Considerando-se a reação abaixo, assinalar a
alternativa CORRETA:
O hidróxido de magnésio (massa molar 58,33g/mol), conhecido como “leite de magnésia”, é frequentemente usado como antiácido para alívio de azia, má digestão e excesso de acidez no estômago. Considerando-se que uma colher (15mL) de leite de magnésia contenha 1.214mg de hidróxido de magnésio, qual a quantidade de matéria (mol) ingerida por um homem que administrou 5 doses (colheres) do medicamento ao longo do dia?
Considerando-se a reação de oxirredução a seguir, assinalar a alternativa CORRETA