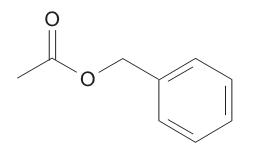
Os ésteres são substâncias amplamente encontradas na natureza, geralmente responsáveis pelo aroma agradável das frutas. O éster visto acima possui um delicioso cheiro de jasmim.
A nomenclatura dessa substância é
A partir da carga nuclear dos átomos e da distribuição dos elétrons em torno do núcleo (com os seus prótons e nêutrons) e, em especial, da quantidade de elétrons na camada de valência, os elementos foram distribuídos na tabela periódica. Pelas suas posições, é possível identificar semelhança de propriedades físicas e químicas, como caráter metálico, tendência a perder ou ganhar elétrons numa ligação, raio atômico, raio iônico, etc.
Com base na distribuição dos elementos na tabela, em grupos e períodos, pode-se prever e afirmar que a(o)
O uso da atomização eletrotérmica em espectrometria de absorção atômica é considerado um avanço do ponto de vista analítico. A característica do uso da atomização eletrotérmica que NÃO implica vantagem em relação ao uso da atomização em chama é a(o)
O eletrodo de membrana de vidro é, provavelmente, o dispositivo de medição mais usado em análises químicas.
Sobre esse eletrodo, analise as afirmativas a seguir.
I - O eletrodo de membrana de vidro é principalmente usado para medição de atividade do íon H+.
II - Para fazer medições quantitativas exatas, o eletrodo de membrana de vidro deve estar associado a eletrodos de referência.
III - Um sistema de medição com o eletrodo de membrana de vidro dispensa o uso de ponte salina.
IV - O potencial de assimetria em um eletrodo de membrana de vidro tem como uma das causas as diferenças entre as superfícies interna e externa da membrana.
Está correto APENAS o que se afirma em
Crioscopia é uma propriedade coligativa na qual o abaixamento da temperatura de congelamento de uma solução é diretamente proporcional à sua molalidade (relação
entre a quantidade de soluto em mol por 1 kg de solvente). Na adição de 1 g de 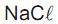 a 3 g de água a 0 °C, ocorre abaixamento da temperatura de congelamento para perto de - 21 °C.
a 3 g de água a 0 °C, ocorre abaixamento da temperatura de congelamento para perto de - 21 °C.
Qual a molalidade (w) aproximada da solução aquosa de 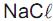 ?
?
A incerteza associada a um resultado analítico tem como origem os erros aleatórios de todas as etapas do processo. A correção de qualquer fonte de erro sistemático do processo se faz necessária para um cálculo de incerteza adequado.
Sobre os erros do processo analítico, pode-se afirmar que
A separação de íons em solução por meio de precipitação seletiva é uma prática muito importante em química analítica. A abordagem que NÃO pode ser usada para separação de íons em solução é a(o)
Um recipiente de vidro de volume igual a 30 L, bem vedado, contém em seu interior 56 g de gás 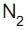 e 16 g de gás
e 16 g de gás 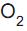 na temperatura de 27 °C.
na temperatura de 27 °C.
Considerando que os gases, nessas condições, não reagem entre si e têm comportamento ideal, a pressão total no interior do recipiente de vidro, em atm, é aproximadamente
Na figura acima, temos três esteroides: a testosterona, que é um hormônio masculino, a estrona, encontrada em urina de gestantes, e o colesterol, que é um potencial causador de obstruções coronárias.
Tanto os esteroides naturais quanto os artificiais caracterizam-se por apresentarem na sua estrutura quatro anéis ligados, como visto nas substâncias ilustradas.
Sobre essas substâncias, afirma-se que
Duas composições gasosas muito usadas na espectrometria de absorção atômica em chama são: i) gás natural/ar e ii) acetileno/óxido nitroso. A mistura (i) produz chama com temperatura em torno de 2700 °C e velocidade máxima de queima de 285 cm/s, enquanto a mistura (ii) produz chama com temperatura em torno de 1800 °C e velocidade de queima de 40 cm/s.
Comparando as características das chamas produzidas por essas duas misturas gasosas, afirma-se que
O método Volhard, usado para determinar o ponto final em argentometria, é baseado na formação do íon complexo vermelho [(Fe(SCN)] 2+ quando excesso de Ag +é titulado com solução aquosa padrão de KSCN (ver etapas abaixo).
Etapa I - Adição de quantidade conhecida de Ag+ para garantir a reação completa com todo íon haleto (X- ) e excesso de Ag+ na solução Ag+(aq) + X- (aq) → AgX(s)
Etapa II - Titulação do excesso de Ag+
Ag+ (aq) + SCN-(aq) → AgSCN(s)
Etapa III - Formação de complexo vermelho com o primeiro excesso de SCN-
SCN- + Fe3+→ [(Fe(SCN)] 2+(aq)
Com base nas informações relativas a cada etapa do processo, analise as afirmações a seguir.
I - O SCN- atua como indicador do ponto ? nal da titulação.
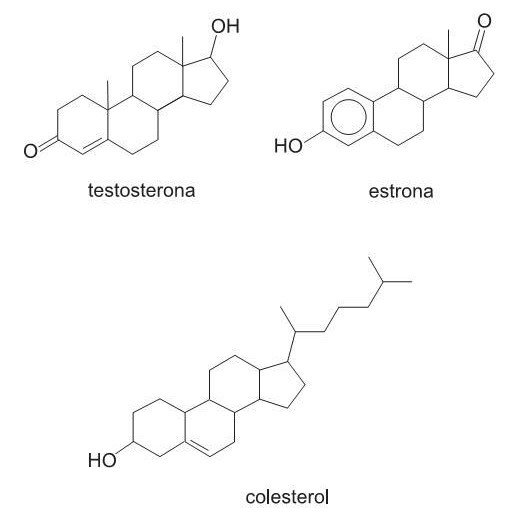
II - Pelo fato de o valor do 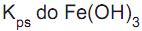 do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido.
do Fe(OH) 3 ser 4 x 10-38 , o método de Volhard só funciona se o pH da solução for muito ácido.
III - O 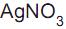 é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz.
é um padrão primário, pois sofre alteração fotoquímica quando exposto à luz.
IV - Nas titulações argentométricas, os sais de prata tipo AgX são bem solúveis em água.
É correto APENAS o que se afirma em
O eletrodo padrão de hidrogênio (EPH) é usado como eletrodo de referência para determinar os potenciais relativos de oxidação e de redução de vários outros sistemas. Infelizmente, devido à sua complexidade de operação, o EPH não é usado comumente nos laboratórios. Em potenciometria, usa-se, por exemplo, o eletrodo de referência saturado de calomelano (ESC), cujo potencial padrão de redução (versus EPH) é +0,241 V.
O potencial de um sistema contendo um eletrodo de Cu 2+(1 mol L-1 ) \ Cu(s) e um ESC é igual a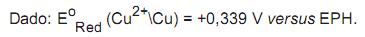

Um técnico dispõe de dois frascos. Um contendo solução de KOH 0,5 mol L-1 e outro contendo solução de NaOH 1,5 mol L-1 . Ele transferiu 40 mL da solução de KOH e 60 mL da solução de NaOH para um cilindro graduado de 1,0 L, acrescentou água destilada até o traço de referência (1,0 L) e, em seguida, homogeneizou bem a mistura.
Com esses procedimentos, ele obteve uma solução final cuja concentração de OH- em quantidade de matéria (mol L-1 ) é
Um técnico tenta identificar um metal específico em um conjunto de três metais desconhecidos que estão sobre sua bancada. Num primeiro experimento, ele colocou cada um dos metais em solução aquosa de ácido clorídrico concentrado e verificou que dois não reagiram. Com aquele que reagiu completamente com o ácido, ele obteve, a partir de 0,0486 g do metal, 44,7 mL de gás hidrogênio, recolhido a 27 °C e na pressão de 1,1 atm.
Considerando os resultados desse experimento, o metal em questão pode ser

