Frequentemente as análises titrimétricas são empregadas, ainda na atualidade, para determinação de inúmeras substâncias, pois são consideradas métodos relativamente baratos, com baixo custo unitário por determinação. A respeito desses métodos, assinale a alternativa correta.
A incorporação de íons fluoreto torna os dentes menos susceptíveis ao surgimento de cáries, e por essa razão o fluoreto de sódio (NaF; 41,98 g.moL-1) é usado na fabricação de cremes dentais e enxaguantes bucais e, em muitas cidades, é adicionado à água tratada, para o consumo humano (água fluoretada). Considerando que um creme dental e um enxaguante bucal apresentam em sua composição 1450 ppm e 210 ppm de fluoreto de sódio, respectivamente, assinale a alternativa que representa a massa total de fluoreto de sódio contida em uma embalagem de 90 g desse creme dental e a concentração percentual de fluoreto de sódio no enxaguante bucal.
Para um procedimento de neutralização ácido-base, foi solicitada a adição de um determinado volume de uma solução de hidróxido de sódio 0,5 mol.L-1 em uma solução de ácido acético 1 mol.L-1. Entretanto, para esse procedimento, o laboratório dispõe apenas de uma solução estoque de hidróxido de sódio 2 mol.L-1. Nesse contexto, assinale a alternativa que apresenta o volume de solução de hidróxido de sódio 2 mol.L-1mL necessário para preparar 50 mL da solução de hidróxido de sódio 0,5 mol.L-1.
A água boricada é uma solução não estéril que contém água e ácido bórico (H3BO3) e é comercializada em drogarias, normalmente, nas concentrações de 2% e 3%. Qual a massa de ácido bórico 3% em uma embalagem de 250 mL?
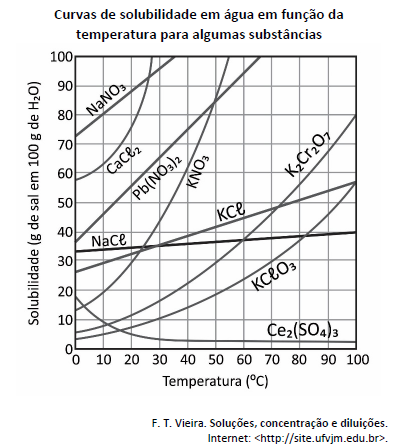
Considerando‐se as massas molares (g mol−1): O = 16; K = 39,1; e Cr = 52 e o gráfico apresentado, a quantidade de matéria aproximada, em mol, de dicromato de potássio contida em 1,3 kg de uma solução saturada desse sal a 50 ºC é igual a
A identificação da presença de cátions metálicos em amostras desconhecidas é importante, para saber qual o método de quantificação a ser empregado, já que a presença de impurezas pode dificultar a análise. Sobre os métodos de identificação de cátions metálicos é CORRETO afirmar:
O rótulo de um frasco encontrado em um armário velho de um laboratório indicava apenas que se tratava de uma solução de ácido sulfúrico, sem indicação da concentração. A fim de determinar a concentração desconhecida, uma amostra de 5,0 mL desta solução foi diluída a 100 mL e, em seguida, titulada com solução de hidróxido de sódio, a 0,20 mol/L. Sabendo que foram consumidos 50 mL de solução alcalina até o ponto de equivalência, indique a alternativa que apresenta a concentração da solução de ácido sulfúrico presente no referido frasco.
A respeito de soluções e concentração de soluções, julgue o item a seguir.
Para soluções aquosas diluídas, cujas densidades sejam iguais a 1 g mL−1−1.
A determinação do OD (oxigênio dissolvido) na água pode ser feita por meio do método Winkler. Nesse método, o OD é fixado através da adição de sulfato de manganês(II), em meio alcalino. Em seguida adicionam-se íons iodeto e o meio é acidificado, ocorrendo liberação de iodo que é titulado com solução de tiossulfato de sódio. Em uma análise de controle, foram coletados 200 mL de água e, após o tratamento preliminar, de acordo com o método Winkler, titulou-se a amostra com solução de Na 2S2O3 0,01 mol/L, consumindo-se 8,0 mL desse reagente. A concentração do oxigênio dissolvido, em mg/L, nessa amostra é
Dados:
1 mol de O2 equivale a 4 mols de Na2S2O3 no método Winkler
Massas molares (g/mol):
Na = 23
S = 32
O = 16
Questão anterior:

De acordo com a metodologia descrita anteriormente para a determinação gravimétrica do cálcio (questão 37), a partir de 150 mL de uma amostra de água natural foram determinados 0,2941 g de CaO (56,077 g.moL-1). Qual a concentração de Ca (40,078 g.moL-1) na amostra de água, expressa em unidades de gramas por 100 mL de água?
A solução fisiológica constitui-se de 9,0 gramas de cloreto de sódio (NaCl) em um litro de água. Assinale a alternativa que apresenta a massa de NaCl em uma embalagem de 100 mL de soro fisiológico, expressa em percentagem.
Recentemente, propuseram o uso da termogravimetria na determinação da curva de equilíbrio sólido-solução entre alguns sais inorgânicos e a água. A respeito da termogravimetria, assinale a alternativa correta.
Preparar soluções equivale a uma tarefa rotineira em um laboratório. Uma solução mal preparada pode ocasionar erros em formulações e análises. A respeito do preparo e armazenamento de uma solução, assinale a alternativa correta.
Que volume de solução se obtém ao diluir uma solução de concentração 25 g/L de NaHCO3 para 10 g/L utilizando 30 L de água pura?
O ácido sulfúrico P.A utilizado no laboratório de Química do IFTO apresenta as seguintes informações no rótulo:
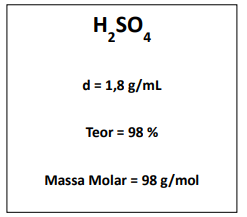
Deseja-se preparar 1 L de solução do ácido a 1 mol/L, partindo do reagente concentrado. Podemos informar que o volume do ácido concentrado a ser usado na preparação vale, aproximadamente: