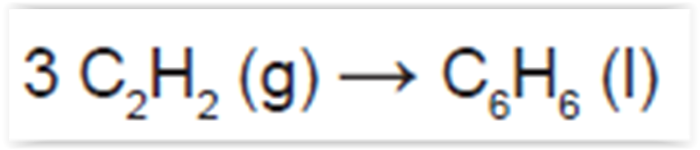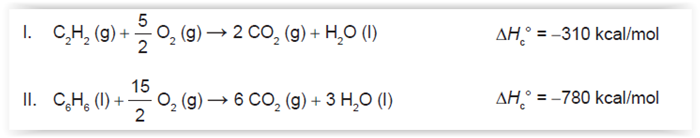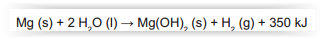O gás hidrogênio é considerado um ótimo combustível — o único produto da combustão desse gás é o vapor de água, como mostrado na equação química.
![]()
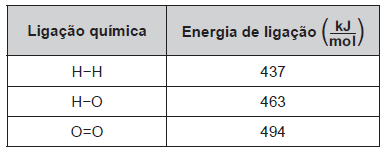
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
Massas molares ![]()
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
Em uma aula experimental de calorimetria, uma professora queimou 2,5 g de castanha-de-caju crua para aquecer 350 g de água, em um recipiente apropriado para diminuir as perdas de calor. Com base na leitura da tabela nutricional a seguir e da medida da temperatura da água, após a queima total do combustível, ela concluiu que 50% da energia disponível foi aproveitada. O calor específico da água é 1 cal g−1 °C−1, e sua temperatura inicial era de 20 °C.
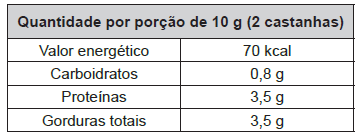
Qual foi a temperatura da água, em grau Celsius, medida ao final do experimento?
Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O2 e a glicose ser convertida em
duas moléculas de ácido lático. As equações termoquímicas para a combustão da glicose e do ácido lático são, respectivamente, mostradas a seguir:
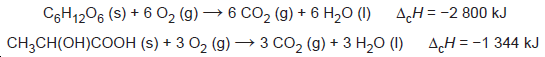
O processo anaeróbico é menos vantajoso energeticamente porque
O etanol é um combustível renovável obtido da cana-de-açúcar e é menos poluente do que os combustíveis fósseis, como a gasolina e o diesel. O etanol tem densidade ![]() massa molar
massa molar ![]() e calor de combustão aproximado de
e calor de combustão aproximado de ![]() Com o grande aumento da frota de veículos, tem sido incentivada a produção de carros bicombustíveis econômicos, que são capazes de render até
Com o grande aumento da frota de veículos, tem sido incentivada a produção de carros bicombustíveis econômicos, que são capazes de render até ![]() em rodovias, para diminuir a emissão de poluentes atmosféricos.
em rodovias, para diminuir a emissão de poluentes atmosféricos.
O valor correspondente à energia consumida para que o motorista de um carro econômico, movido a álcool, percorra 400 km na condição de máximo rendimento é mais próximo de
O monóxido de carbono (CO) é um gás extremamente tóxico. Ele interfere no processo respiratório dos vertebrados, pois se o CO estiver presente no ar, haverá no sangue uma “competição" entre o CO e o O2.
Infelizmente, grande parte da população convive diariamente com a presença desse gás, uma vez que ele é produzido em grandes quantidades
O carro flex é uma realidade no Brasil. Estes veículos estão equipados com motor que tem a capacidade de funcionar com mais de um tipo de combustível. No entanto, as pessoas que têm esse tipo de veículo, na hora do abastecimento, têm sempre a dúvida: álcool ou gasolina? Para avaliar o consumo desses combustíveis, realizou-se um percurso com um veículo flex, consumindo 40 litros de gasolina e no percurso de volta utilizou-se etanol. Foi considerado o mesmo consumo de energia tanto no percurso de ida quanto no de volta.
O quadro resume alguns dados aproximados sobre esses combustíveis.
O volume de etanol combustível, em litro, consumido no percurso de volta é mais próximo de
Na oxidação de 1,0 grama de glicose, a energia obtida para atividade muscular, em quilojoule, é mais próxima de
O ferro é encontrado na natureza na forma de seus minérios, tais como a hematita (α-Fe2O3)' a magnetita (Fe3O4) e a wustita (FeO). Na siderurgia, o ferro-gusa é obtido pela fusão de minérios de ferro em altos fornos em condições adequadas. Uma das etapas nesse processo é a formação de monóxido de carbono.O CO (gasoso) é utilizado para reduzir o FeO (sólido), conforme a equação química:
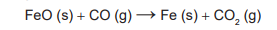
Considere as seguintes equações termoquímicas:
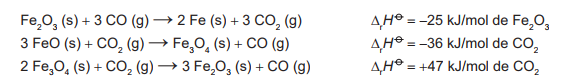
O valor mais próximo de Δt H , em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
, em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
Os combustíveis de origem fóssil, como o petróleo e o gás natural, geram um sério problema ambiental, devido à liberação de dióxido de carbono durante o processo de combustão. O quadro apresenta as massas molares e as reações de combustão não balanceadas de diferentes combustíveis.
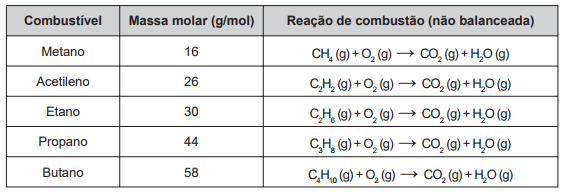
Considerando a combustão completa de 58 g de cada um dos combustíveis listados no quadro, a substância que emite mais CO2 é o
Para comparara eficiência de diferentes combustíveis, costuma-se determinar a quantidade de calor liberada na combustão por mal ou grama de combustível. O quadro mostra o valor de energia liberada na combustão completa de alguns combustíveis.
Qual combustível apresenta maior liberação de energia por grama?
O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do
petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico sob altas
temperaturas, conforme a equação química:
A energia envolvida nesse processo pode ser calculada indiretamente pela variação de entalpia das reações de
combustão das substâncias participantes, nas mesmas condições experimentais:
A variação de entalpia do processo de trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de
Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
O aquecimento dentro da bolsa ocorre por causa da

Qual é a massa de CO2, em toneladas, que deixa de ser
liberada na atmosfera, para cada 100 g de pastilhas de
urânio enriquecido utilizadas em substituição ao carvão
como fonte de energia?
O aproveitamento de residuos florestais vem se
tornando cada dia mais atrativo, pois eles são uma fonte
renovavel de energia. A figura representa a queima de um bio-oleo extraido do residuo de madeira sendo Δ H1
a variação de entalpia devido à queima de 1 g desse
bio-óleo, resultando em gás carbônico e água líquida, e
Δ H2 a variação de entalpia envolvida na conversão de 1 g
de água no estado gasoso para o estado líquido.
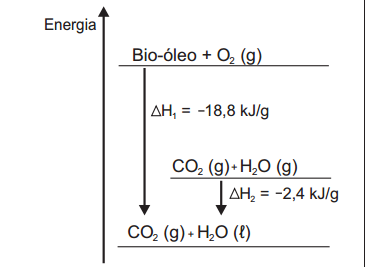
A variação de entalpia, em kJ, para a queima de 5 g desse
bio-óleo resultando em CO2 (gasoso) e H2O (gasoso) é:
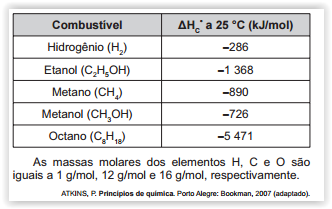
A escolha de uma determinada substãncia para ser utilizada como combustível passa pela análise da poluição que ela causa ao ambiente e pela quantidade de energia liberada em sua combustão completa. O quadro apresenta a entalpia de combustão de algumas substãncias. As massas molares dos elementos H, C e O são, respectivamente, iguais a 1 g/mol, 12 g/mol e 16 g/mol.

Levando-se em conta somente o aspecto energético, a substãncia mais eficiente para a obtenção de energia, na combustão de 1 kg de combustível, é o