Em relação às propriedades gerais dos sólidos no estudo de
soluções, julgue os itens subsequentes.
Sólido é uma forma rígida de matéria que mantém a mesma forma qualquer que seja a forma de seu recipiente. Um sólido molecular consiste em um conjunto de moléculas unidas por forças intermoleculares.
No que se refere às ligações químicas e à geometria
molecular, julgue os itens subsecutivos.
No modelo de repulsão de pares eletrônicos da camada de valência, regiões de densidade eletrônica aumentada assumem posições tão separadas quanto possível e a geometria da molécula é identificada referindo-se às localizações dos átomos na estrutura resultante.
Em relação às propriedades gerais dos sólidos no estudo de
soluções, julgue os itens subsequentes.
Quando 22,20 g de cloreto de cálcio (de fórmula CaCl2 e massa molar igual a 111 g mol-1) são solubilizados em água até formar uma solução de volume igual a 1.000 mL, a concentração de íons cloreto na solução é igual a 0,4 mol L-1
Em relação às propriedades gerais dos sólidos no estudo de
soluções, julgue os itens subsequentes.
Em uma titulação ácido-base, um ácido é titulado com outro ácido com o objetivo de determinar a sua concentração. Nesse caso, o titulante é uma solução de concentração conhecida adicionada por meio de uma bureta.
Em relação às propriedades gerais dos sólidos no estudo de
soluções, julgue os itens subsequentes.
Titulação é a análise da composição por meio da medida da massa de um reagente necessária para reagir completamente com uma dada amostra desconhecida em solução.
O nitrogênio amoniacal é um parâmetro relevante para avaliação
da qualidade da água e pode ser determinado pelo método de
Kjeldahl.
Utilizando esse método, todo o nitrogênio de uma amostra de
um efluente foi adequadamente transformado em amônia que
foi recolhida em solução de ácido bórico. Posteriormente o
borato formado foi titulado, consumindo 24 mL de solução
padrão de ácido sulfúrico 0,5 mol.L-1.
A massa de nitrogênio (em mg) presente na amostra, é
aproximadamente igual a
Dados: Massa molares (g.mol-1) H3BO3 = 62, H2SO4 = 98, NH3 = 17 e N =14
O soro fisiológico é uma solução aquosa de
cloreto de sódio (NaCl) comumente utilizada para
higienização ocular, nasal, de ferimentos e de lentes
de contato. Sua concentração é 0,90% em massa e
densidade igual a 1,00 g/mL.
Qual massa de NaCl, em grama, deverá ser adicionada à
água para preparar 500 mL desse soro?
Para demonstrar a digestão do amido pela saliva, o professor sugeriu um experimento com dois tubos de ensaio preparados com o seguinte conteúdo: Tubo 1: 2 mL de solução de amido e 2 mL de saliva. Tubo 2: 2 mL de solução de amido. Após 10 minutos, uma gota de iodo diluído foi adicionada a cada tubo. Depois de muita discussão, a turma chegou à conclusão de que o experimento estava incompleto e que, para melhorá-lo, seria necessário: I.substituir o tubo 2 por outro igual, porém com mais 2 mL de água. II.acrescentar um tubo 3, contendo 4 mL de água. III.acrescentar um tubo 4, com 2 mL de saliva mais 2 mL de água. Para resultados mais seguros seria necessário modificar o experimento conforme indicado
O conceito de solubilidade pode ser trabalhado em sala de aula
por meio de análise da curva de solubilidade apresentada sob a
forma de gráficos e/ou da realização de experimentos simples
que mostrem os fatores que alteram a solubilidade.
Após uma discussão sobre esse assunto em sala de aula foram
levantados pelos alunos alguns fatores que alteram a solubilidade
tais como: o solvente, o ponto de fusão do soluto, a temperatura
da solução, a pressão, as interações intermoleculares envolvidas.
O fator apresentado pelos alunos que deve ser rediscutido por
não influenciar na solubilidade das substâncias é
A hidroponia pode ser definida como uma técnica
de produção de vegetais sem necessariamente a
presença de solo. Uma das formas de implementação
é manter as plantas com suas raízes suspensas em
meio líquido, de onde retiram os nutrientes essenciais.
Suponha que um produtor de rúcula hidropônica
precise ajustar a concentração do íon nitrato (NO3)
para 0,009 mol/L em um tanque de 5 000 litros e, para
tanto, tem em mãos uma solução comercial nutritiva
de nitrato de cálcio 90 g/L. As massas molares dos
elementos N, O e Ca são iguais a 14 g/mol, 16 g/mol e
40 g/mol, respectivamente.
Qual o valor mais próximo do volume da solução nutritiva,
em litros, que o produtor deve adicionar ao tanque?
A obtenção de sistemas coloidais estáveis depende
das interações entre as partículas dispersas e o meio
onde se encontram. Em um sistema coloidal aquoso,
cujas partículas são hidrofílicas, a adição de um solvente
orgânico miscível em água, como etanol, desestabiliza
o coloide, podendo ocorrer a agregação das partículas
preliminarmente dispersas.
A desestabilização provocada pelo etanol ocorre porque
A cafeína é um alcaloide, identificado como 1,3,7-trimetilxantina (massa molar igual a 194 g/mol), cuja estrutura química contém uma unidade de purina, conforme representado. Esse alcaloide é encontrado em grande quantidade nas sementes de café e nas folhas de chá-verde. Uma xícara de café contém, em média, 80 mg de cafeína.

Considerando que a xícara descrita contém um volume de 200 mL de café, a concentração, em mol/L, de cafeína nessa xícara é mais próxima de:
O vinagre vem sendo usado desde a Antiguidade
como conservante de alimentos, bem como agente de
limpeza e condimento. Um dos principais componentes
do vinagre é o ácido acético (massa molar 60 g/mol), cuja
faixa de concentração deve se situar entre 4% a 6% (m/v).
Em um teste de controle de qualidade foram analisadas
cinco marcas de diferentes vinagres, e as concentrações
de ácido acético, em mol/L, se encontram no quadro.

A amostra de vinagre que se encontra dentro do limite de
concentração tolerado é a
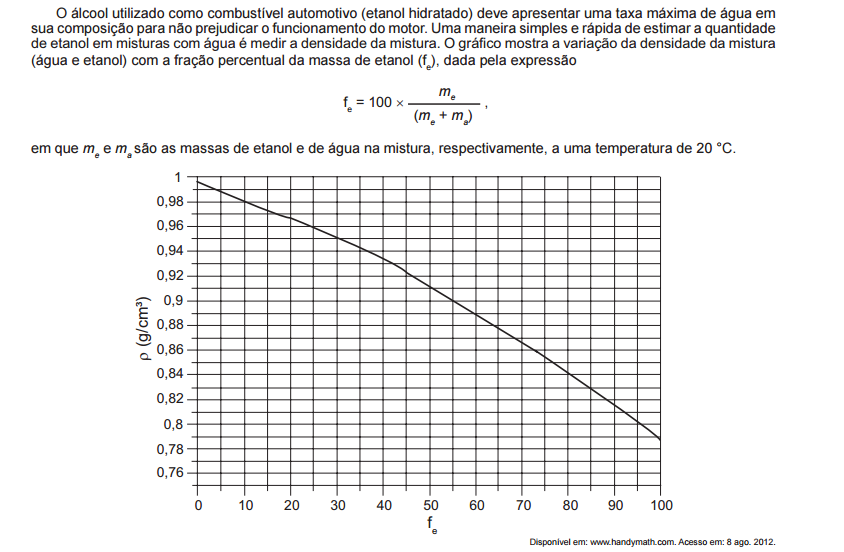
Suponha que, em uma inspeção de rotina realizada em determinado posto, tenha-se verificado que 50,0 cm3 de alcool
combustível tenham massa igual a 45,0 g. Qual é a fração percentual de etanol nessa mistura?
Em um caso de anemia, a quantidade de sulfato de ferro(II) (FeSO4, massa molar igual a 152 g/mol) recomendada como suplemento de ferro foi de 300 mg/dia. Acima desse valor, a mucosa intestinal atua como barreira, impedindo a absorção de ferro. Foram analisados cinco frascos de suplemento, contendo solução aquosa de FeSO4, cujos resultados encontram-se no quadro.

Se for ingerida uma colher (10 mL) por dia do medicamento para anemia, a amostra que conterá a concentração de sulfato de ferro(II) mais próxima da recomendada é a do frasco de número

