Quando observada uma molécula de H2, por exemplo, sabe-se que os dois elétrons dessa molécula estão igualmente compartilhados entre os dois átomos, formando ligações do tipo não-polares, ou apolares. Porém, moléculas com diferentes ligantes possuem comportamento diferenciado. Analise as afirmações a seguir:
I. Átomos de dois elementos diferentes podem possuir afinidades iguais por elétrons.
II. A ligação H - Cl possui carga parcial negativa no átomo de cloro.
III. Espera-se que a molécula de HF tenha uma maior polaridade que a molécula de HCl.
IV. Em ligações do tipo covalente pura, há uma completa transferência de elétrons de um átomo para outro.
Assinale a alternativa que contém as afirmações verdadeiras:
Observe o esquema abaixo.
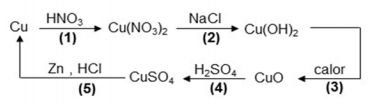
O esquema representa de forma abreviada as reações químicas do ciclo do cobre. As etapas em que o cobre é, respectivamente, oxidado e reduzido são as

Considere as reações I, II e III a seguir.
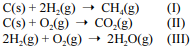
Com relação a essas informações, julgue o item que se segue.
De acordo com a teoria da ligação de valência, nas moléculas de metano e de água ocorre a hibridização para se formar um orbital híbrido do tipo sp3 , o que leva as duas moléculas a terem arranjos eletrônicos tetraédricos.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
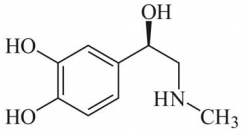
A estrutura química da epinefrina, mostrada a seguir, dispõe de sítios capazes de interagir com seus receptores no organismo, por meio de interações químicas de Van der Waals e de ligação de hidrogênio, além de ligação iônica.
O pentacloreto de fósforo é um sólido iônico composto de cátions PCl4+ e ânions PCl6- . Indique a alternativa que contém as formas geométricas do PCl4+ e PCl6- , respectivamente.
O tetrafluoreto de xenônio é um sólido cristalino, formado como um dos produtos da reação direta entre os gases flúor e xenônio a cerca de 400 ºC. Ele é um composto muito reativo, podendo provocar explosões, incêndios e queimaduras.
A geometria molecular e o tipo de hibridação do átomo central no tetrafluoreto de xenônio são, respectivamente,
No que se refere às ligações químicas e à geometria
molecular, julgue os itens subsecutivos.
No modelo de repulsão de pares eletrônicos da camada de valência, regiões de densidade eletrônica aumentada assumem posições tão separadas quanto possível e a geometria da molécula é identificada referindo-se às localizações dos átomos na estrutura resultante.
Alguns pr°Cessos de obtenção de H2SO4 utilizam pirita (FeS2) como matérIa-prima no lugar de enxofre elementar (S8).
Esses pr°Cessos podem ser descritos resumidamente pelas seguintes equações, nas quais se pode notar varIações no
estado de oxidação do enxofre:
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
De acordo com o texto, assinale a alternativa que apresenta os estados de oxidação do enxofre nas espécies FeS2, SO2,
SO3 e H2SO4, respectivamente.
O etanol pode ser obtido pela fermentação do caldo da cana-de-açúcar e possui fórmula CH3 CH2OH. Uma amostra de etanol puro, sem água e outros contaminantes, ao ser aquecida, entrará em ebulição a aproximadamente 78°C. As forças intermoleculares que estão atuando, unindo as moléculas de etanol umas às outras, sendo vencidas durante a mudança de fase líquido para vapor, são:
Considerando as espécies química apresentadas no quadro a seguir, complete o número de oxidação do elemento químico que se pede e assinale a alternativa correta:
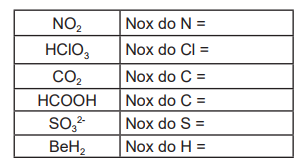
Assinale a alternativa que corresponde aos números de oxidação na ordem em que aparecem no quadro:
Os números de oxidação do elemento químico cloro nas substâncias KClO2 e Ba(ClO4)2 são iguais a α e β, respectivamente. Logo, o valor de α + β é igual a:
Para compostos iônicos, o número de oxidação, chamado algumas vezes de carga de um elemento, é igual ao número de elétrons perdidos ou ganhos. Para compostos covalentes, nos quais os elétrons são compartilhados e não transferidos, os números de oxidação são atribuídos aos elementos com base em algumas regras, sobre esse tema assinale a alternativa incorreta:
Em um experimento visando determinar a polaridade de alguns compostos, observou-se que as moléculas de C02, NH3 e BF3 têm diferentes momentos de dipolo. A relação de polaridade entre esses compostos é:
Considerando os compostos a seguir:
MnO2, KMnO4 e MnCI2
O número de oxidação (Nox) do átomo de manganês
em cada composto, respectivamente, é igual a:
Para uma molécula com mais de dois
átomos, o momento de dipolo depende tanto das
polaridades das ligações individuais quanto da
geometria da molécula. Os dipolos de ligação e
os momentos de dipolo são grandezas vetoriais;
isto é, eles possuem módulo, direção e sentido.
O dipolo total de uma molécula poliatômica é a
soma de seus dipolos de ligação. Sendo assim,
qual substância é uma molécula com momento
de dipolo diferente de zero?