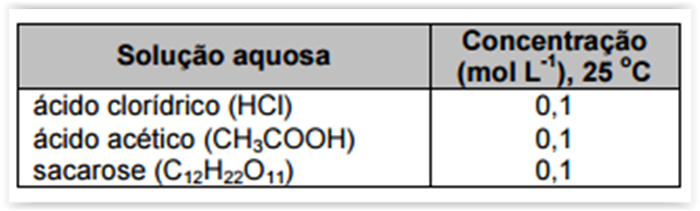
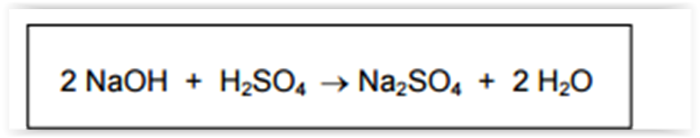A técnica de condutometria direta pode avaliar o comportamento de soluções aquosas
quanto à condução de corrente elétrica, por meio de medidas de condutância. Essa condutância é um
resultado da soma da contribuição individual de cada íon presente na solução. A tabela a seguir mostra
diferentes tipos de soluções aquosas e suas concentrações.
Considerando as medidas de condutância que poderiam ser obtidas para essas soluções, é CORRETO
afirmar:
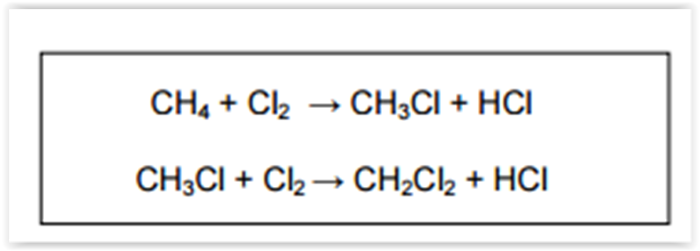
A obtenção do diclorometano (CH2Cl2), um solvente orgânico utilizado na indústria química,
ocorre em duas etapas. Na primeira etapa, o clorometano (CH3Cl) é produzido devido à reação entre o
metano (CH4) e o gás cloro. Na segunda etapa, o clorometano produzido reage com gás cloro formando o
diclorometano. Essas reações ocorrem em temperatura adequada na presença de luz e em um mesmo
reator.
As reações mostradas acima para a obtenção de diclorometano são de
Considere um recipiente fechado de paredes rígidas, com volume constante de três litros,
contendo um mol de gás ideal a uma pressão de 5 atm e 0 °C. Quando esse sistema é aquecido até uma
temperatura de 273 °C, a pressão, em atm, do gás dentro do recipiente deverá ser:
A equação abaixo representa a reação de neutralização entre hidróxido de sódio (NaOH) e
ácido sulfúrico (H2SO4).
O volume, em litros (L), de uma solução de H2SO4 1,0 mol L-1
que reage com 0,5 mol de NaOH é:
A solução concentrada de ácido perclórico (HClO4) possui densidade de 1,70 g mL-1 e 70 % de pureza. Para preparar uma solução diluída de ácido perclórico, mediu-se um volume de 5,00 mL da solução concentrada e diluiu-se para 250 mL em um balão volumétrico, completando-se o volume com água destilada. A concentração final, em mol L-1 , dessa solução diluída foi
Em um laboratório de análises químicas, solicitou-se ao técnico o preparo e a padronização
de soluções de hidróxido de sódio (NaOH) e ácido clorídrico (HCl), ambas na concentração de 0,1 mol L-1
.
Dessa forma, o técnico procedeu a pesagem da massa de NaOH calculado em um béquer e dissolveu em
água destilada, agitando com o auxílio de um bastão de vidro. Transferiu a solução para um balão
volumétrico e completou-o com água até a marca da aferição. Posteriormente, mediu um volume adequado
de solução concentrada de ácido clorídrico e transferiu para um balão volumétrico preenchido parcialmente
com água destilada, completando o volume com água até a marca da aferição. A padronização da solução
de NaOH foi feita por titulometria, utilizando biftalato de potássio como padrão. Em seguida, o técnico
utilizou essa solução padronizada para descobrir a concentração verdadeira da solução de HCl, também por
titulometria. Analisando esse procedimento, é CORRETO afirmar:
O Cr de uma superfície cromada de dimensões 3,00 x 5,00 cm foi dissolvido em ácido clorídrico. O pH da solução foi ajustado e, posteriormente, foram adicionados 15,00 mL de solução padrão de EDTA 0,200 mol L-1 . O reagente em excesso foi retrotitulado com um volume de 4,00 mL de solução padrão de Cu2+ 0,100 mol L-1 . A massa aproximada, em mg, de Cr em cada centímetro quadrado da superfície foi
Os métodos potenciométricos de análise se baseiam em medidas do potencial de células eletroquímicas na ausência de correntes apreciáveis. O potencial medido está relacionado com a composição química dos eletrodos e das soluções nas quais estão submersos. Considerando as características desses métodos, analise as afirmativas que se seguem. I.O eletrodo adequado para medidas de pH mede o potencial que se desenvolve através de uma fina membrana de vidro que separa duas soluções com diferentes concentrações do íon hidrogênio. II.A potenciometria é uma técnica eletroanalítica em que se obtêm medidas de potencial geradas por espécies químicas em um meio, sem a necessidade da utilização de um eletrodo de referência. III.A medida do potencial de um eletrodo indicador pode ser utilizada para determinar o ponto de equivalência de uma titulação. É CORRETO
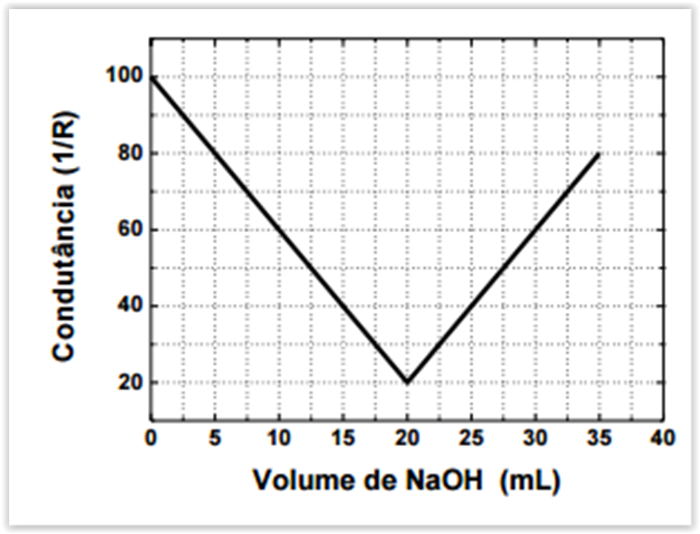
Em uma titulação condutométrica, uma amostra de 5 mL de HCl foi titulada com NaOH 0,10 mol L-1
padrão. A partir do gráfico de condutância vs. volume de solução de NaOH adicionado na
titulação, é CORRETO afirmar que a concentração, em mol por litro, da solução de HCl titulada é
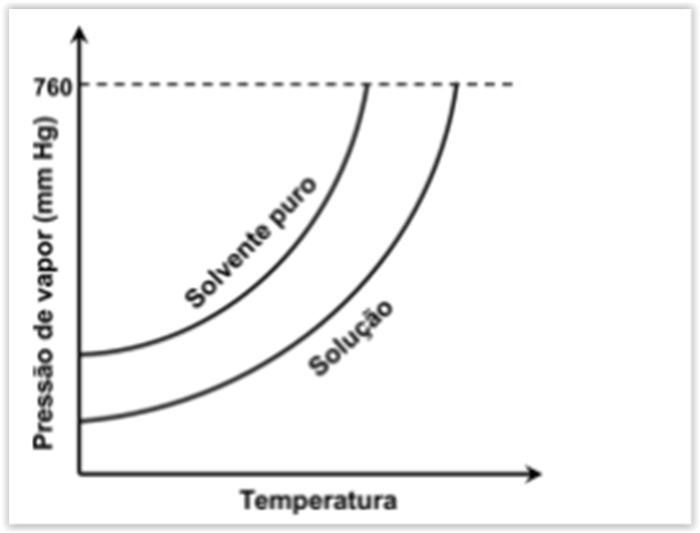
Considere o gráfico da pressão de vapor em função da temperatura, para um solvente puro
e para uma solução desse solvente contendo um soluto molecular não volátil.
A partir do gráfico, é CORRETO afirmar:
Um volume de 500 mL de uma solução 1,0 mol L-1 de cloreto de sódio (NaCl) foi misturado a 1.500 mL de uma outra solução 2,0 mol L-1 de NaCl, completando-se com água até atingir o volume final de 2.500 mL. A concentração, em mol L-1 , da solução resultante é
A tabela a seguir fornece os valores de pH ou pOH de soluções.
A respeito da concentração molar de íons hidrogênio [H+] presente nas soluções, é CORRETO afirmar:
A quantidade de carbono em um composto orgânico foi determinada através da queima de 0,2121 g do composto em um fluxo de oxigênio. O CO2 produzido na reação foi coletado em uma solução de hidróxido de bário. Se 0,6000 g de BaCO3 foi formado, a porcentagem de carbono na amostra é
A técnica de cromatografia é utilizada para separação, identificação e quantificação de componentes químicos em misturas complexas. Essa técnica se baseia na distribuição de substâncias entre duas fases químicas ou físicas, sendo uma fase estacionária e a outra fase móvel ao longo do sistema. Com relação aos diferentes tipos de técnicas cromatográficas, é INCORRETO afirmar: