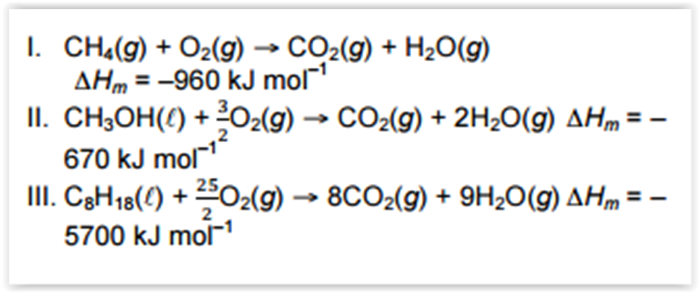A palavra cinética, no caso da Química, refere-se à
velocidade de uma reação, isto é, à variação da
concentração de desaparecimento de um reagente
ou de surgimento de um produto com o tempo. Para
exemplificar, considere que a 280 °C, o dióxido de
nitrogênio se decompõe no óxido nítrico e oxigênio:
2NO 2(g ) → 2NO(g ) + O2(g )
E que em um experimento, a concentração de NO 2
diminui de 0,010 mol L –1 a 0,005 mol L–1
no período de
100 s. Qual é a velocidade média de desaparecimento
de NO2?
Nos Estados Unidos (USA), os postos de
combustíveis automotivos geralmente
disponibilizam gás (CH4, metano), metanol (CH3OH,
álcool metílico) e gasolina (C8H18, fórmula química
aproximada), respectivamente. A reação de
combustão completa e energia liberada na forma de
calor desses combustíveis são apresentadas a
seguir:
Com base nos dados estabeleça a ordem
decrescente dos combustíveis em relação a energia
liberada com uma mesma quantidade em massa.
No laboratório, principalmente de Química, o acondicionamento de soluções ácidas e básicas deve ser uma prática adequada e correta, para evitar alteração na composição e outros danos. Das alternativas a seguir, indique a forma CORRETA de acondicionamento de solução de ácido sulfúrico e de solução de ácido fluorídrico, respectivamente:
Relacione o tipo de resíduo químico (coluna à esquerda)
com o respectivo exemplo (coluna à esquerda):
Tipo de Resíduos
Químicos
I. Básicos
II. Metais preciosos ou recicláveis
III. Oxidantes fortes
IV. Redutores fortes (exceto metais e ligas)
V. Solventes descartáveis
VI. Solventes recicláveis
Exemplo
( ) Soluções ou sais de dicromato, permanganato, hipoclorito, iodato, persulfato, bismuto (III). Solução de bromo, iodo, peróxido de idrogênio. Sólidos: bismutato de sódio, dióxido de chumbo e ácido crômico.
( ) Cabeça e cauda de destilação, solvente de limpeza, solventes contaminados de difícil purificação e misturas azeotrópicas.
( ) Hidrazina, soluções ou sais de sulfito, iodeto, tiossulfato, oxalato, ferro (II), estanho (II) e fósforo vermelho.
( ) Aminas, soluções de hidróxidos, soda cáustica, solução alcoolato e amônia.
( ) Solventes de HPLC, extração Sohxlet e rotaevaporados, e formol.
( ) Sais ou soluções contendo prata, ósmio, ouro, platina e rutênio.
Assinale a alternativa com a sequência CORRETA
de cima para baixo:
As variações de entalpia que ocorrem durante as reações químicas com frequência têm o mesmo interesse prático que as relações de massas, pois, no caso das reações de combustão, que envolvem combustíveis como o gás natural e petróleo, são realizadas cotidianamente mais pela energia térmica que liberam do que pelos seus produtos da combustão. Por exemplo, a combustão de 1,00 mol de metano, CH4, produz dióxido de carbono e água e libera 802 kJ mol–1 . Quando 3,00 mol de oxigênio reagem com uma quantidade estequiométrica de metano, qual é ?H para a reação?
Devido à grande emissão de gases lançados na
atmosfera, nas regiões mais populosas é evidente a
ocorrência da chuva ácida. Na sua precipitação, um
dos ácidos responsáveis pela acidez é o sulfúrico.
Um equilíbrio envolvido na formação desse ácido na
água da chuva está representado pela equação:
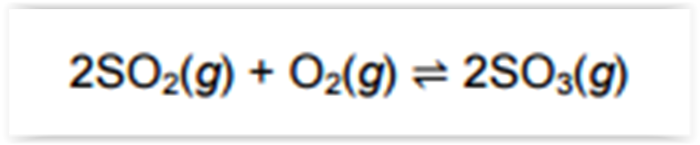
Considere que são colocados 6 mol de SO2, 5 mol
de O 2 e 4 mol de SO3 num recipiente fechado de 5,0 L
para reagirem até o sistema atingir o equilíbrio a dada
temperatura. A variação do número de mol dos gases
participantes está registrada no gráfico.
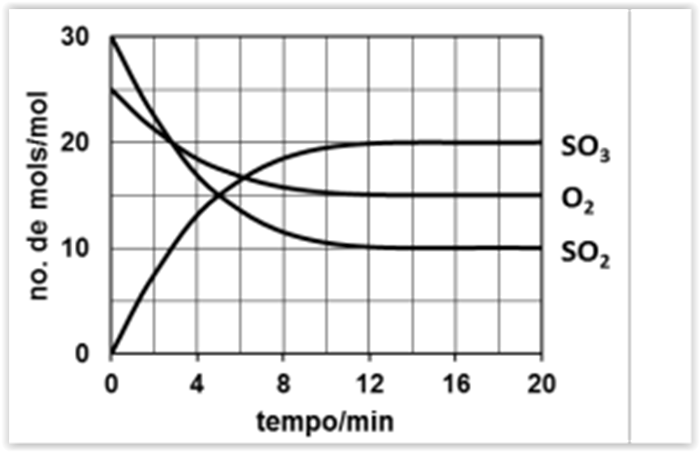
Nestas condições, a constante de equilíbrio, KC, é igual a:
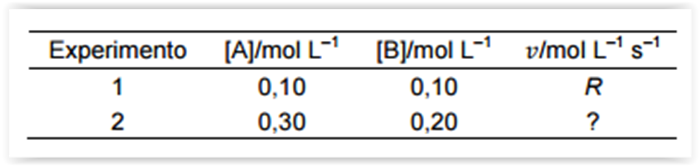
Existem muitos motivos para estudar a velocidade
de uma reação, do ponto de vista prático, o
conhecimento das velocidades de reações é útil na
concepção de medicamentos, no controle da
poluição e no processamento de alimentos, bem
como nas aplicações de setores produtivos em
geral. Então para exemplificar, considere que a
velocidade de uma reação entre os compostos A e
B segue a lei de velocidade,
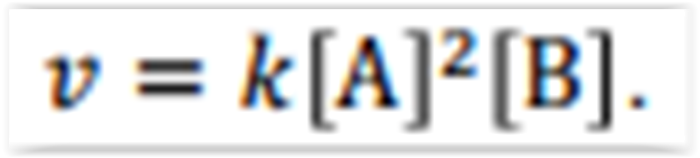
velocidade do Experimento 2 observada a mesma
temperatura do Experimento 1.