Julgue os itens a seguir, a respeito de fenômenos relativos
à termodinâmica.
Em qualquer processo termodinâmico que ocorra entre dois
estados de equilíbrio, o resultado da soma da entropia do
sistema com a entropia da vizinhança pode diminuir
ao longo do processo.
O manual de um automóvel alerta sobre os cuidados em relação à pressão do ar no interior dos pneus. Recomenda-se que a pressão seja verificada com os pneus frios (à temperatura ambiente). Um motorista, desatento a essa informação, realizou uma viagem longa sobre o asfalto quente e, em seguida, verificou que a pressão 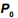 no interior dos pneus não era a recomendada pelo fabricante. Na ocasião, a temperatura dos pneus era
no interior dos pneus não era a recomendada pelo fabricante. Na ocasião, a temperatura dos pneus era 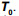 . Após um longo período em repouso, os pneus do carro atingiram a temperatura ambiente T. Durante o
. Após um longo período em repouso, os pneus do carro atingiram a temperatura ambiente T. Durante o
resfriamento, não há alteração no volume dos pneus e na quantidade de ar no seu interior. Considere o ar dos pneus um gás perfeito (também denominado gás ideal).
Durante o processo de resfriamento, os valores de pressão em relação à temperatura (P × T) são representados pelo gráfico:
Julgue os itens a seguir, a respeito de fenômenos relativos
à termodinâmica.
Em uma transição de fase, uma substância pode absorver
grandes quantidades de calor sem variar a sua temperatura.
Com relação à história e evolução das ideias da física, julgue os seguintes itens.
Quando a temperatura de um corpo aumenta, em geral
observa-se uma expansão de suas dimensões, o que ocorre
devido ao aumento da energia interna do material.
Julgue os itens a seguir, a respeito de fenômenos relativos
à termodinâmica.
Os processos termodinâmicos que acontecem na natureza
são todos reversíveis.
Um gás ideal sofre o processo cíclico abca mostrado no diagrama
p x T.

O gráfico que contém o diagrama p x V equivalente ao ciclo p x T é
A figura anterior mostra um êmbolo preso que mantém um gás ideal confinado em um pequeno volume V0 de um recipiente cilíndrico muito longo e com paredes adiabáticas. A parte do cilindro não ocupada pelo gás é um vácuo. O gás confinado está em equilíbrio termodinâmico com uma pressão P0 e tem coeficiente adiabático dado por y. Em certo instante, o êmbolo (de área A) é liberado e pode deslocar-se livremente sem atrito ao longo do cilindro, então, o gás se expande, empurrando o êmbolo. Essa expansão é dada por um processo quase-estático adiabático. Nessa situação, quando o gás tiver expandido até um certo volume V > V0, com menor que o volume total do cilindro, teremos que a força resultante sobre o êmbolo será dada por
A figura precedente mostra o diagrama P - V, que descreve o ciclo termodinâmico de um motor. A substância de trabalho é um gás ideal simples constituído por moléculas com grau de liberdade g. Os processos AB e CD são processos isotérmicos de expansão e contração respectivamente. O fator de aumento proporcional da pressão 4 e de aumento proporcional do volume 5 são ambos maiores do que 1.
Considerando essas informações, é correto afirmar que o trabalho realizado pelo gás neste ciclo será dado por
Aquece-se uma amostra de uma substância, inicialmente na fase sólida, com o auxílio de uma fonte térmica que lhe fornece calor mantendo uma potência constante. O gráfico a seguir mostra como sua temperatura varia em função do tempo.

O calor latente de fusão dessa substância é 140 cal/g. Nesse caso, seu calor específico na fase sólida é
Considere que n moles de um gás ideal, com calor específico molar a volume constante dado por CV sofra um processo de expansão de um volume V1 para um volume maior V2, descrito no diagrama p - V mostrado na figura precedente (no processo considerado, a pressão é linearmente proporcional ao volume).
Com base nessas informações, considerando que R seja a constante universal dos gases, a variação de entropia SB - SA nesse processo é
Considere um cilindro no qual está contido um gás. O cilindro tem um êmbolo móvel, e a sua extremidade inferior está tampada. Este cilindro é mergulhado em água, que é aquecida por meio de um bico de Bunsen, conforme ilustrado na figura abaixo.

Os dados coletados durante um experimento estão expressos na tabela abaixo:

Segundo a lei de Charles, a relação entre o volume e a temperatura, à pressão constante, é linear: V = kT.
De acordo com os dados da tabela, o valor dessa constante k, em ml/K, é aproximadamente:
Em um determinado reservatório térmico, 500 g de água a 100 ºC são convertidos em vapor a 100 ºC, à pressão atmosférica de 1 atm. O volume da água varia de um valor inicial de 1 . 10‐3 m3 do líquido para 1,5 m3 do vapor, 1 atm ≅ 1 . 105 Pa e o calor latente de vaporização da água é igual a 2.256 kJ/kg.
Com base nessa situação hipotética, assinale a alternativa que apresenta o intervalo de variação da energia interna ( ΔEint) , em kJ, do sistema durante todo o processo.
Em um laboratório, uma determinada quantidade de gás hélio é colocada em um tanque provido de sensores de volume, temperatura e pressão. Por meio de um êmbolo, o volume do gás hélio, considerado ideal, pode ser alterado sem que haja vazamentos. A temperatura do gás também pode ser ajustada. O sistema foi ajustado para quatro estados de equilíbrio termodinâmico, e os resultados das medições de pressão e volume foram registrados no gráfico mostrado na Figura abaixo.
A razão 
Um tanque contém gás a uma temperatura de 27 ºC, cujo peso unitário é de 400 N/m3. O manômetro do tanque indica uma pressão de 24 bar (1 bar = 105 Pa). Considerando que esse gás se comporta como um gás ideal, o valor para a constante R desse gás é:




