Um mole de um gás monoatômico ideal, inicialmente a uma temperatura T, se expande de um volume V até um volume 2V em duas situações:
(i) a temperatura constante;
(ii) a pressão constante.
Com relação ao trabalho realizado na expansão e ao calor absorvido pelo gás, em cada situação, é CORRETO afirmar que:
Dois objetos feitos do mesmo material (mármore, por exemplo) possuem capacidades térmicas proporcionais a suas massas. Assim, é conveniente definir uma “capacidade térmica por unidade de massa", ou calor específico (c), que se refere não a um objeto, mas a uma massa unitária do material de que é feito o objeto. Já quando o calor é transferido para uma amostra sólida ou líquida, nem sempre a temperatura da amostra aumenta. Em vez disso, a amostra pode mudar de fase (ou de estado). No caso, a quantidade de energia por unidade de massa que deve ser transferida em forma de calor para que uma amostra mude totalmente de fase é chamada de calor de transformação e é representada pela letra L.
Halliday e Resnick. Fundamentos de Física: gravitação, ondas
e termodinâmica. v. 2. Rio de Janeiro: LTC, 2009 (com adaptações).
A partir do texto acima, assinale a alternativa que apresenta
a quantidade de calor que uma amostra de gelo de massa m = 100 g a –10 ºC deve absorver para passar ao estado líquido a 20 ºC, sendo o calor específico do gelo (cgelo) igual a 2.220 J/kg.K, o calor específico da água (cágua) igual a 4.190 J/kg.K e o calor de fusão do gelo (LF) igual a 333 kJ/kg.
Dentro de um calorímetro de capacidade térmica desprezível, são misturados 200 g de esferas de ferro à temperatura de 100°C e 500 g de água à temperatura de 20°C. O sistema é fechado e, após um determinado tempo, podemos afirmar que a temperatura de equilíbrio vale, aproximadamente:
Dados: Calor específico da água: 1 cal/g°C; calor específico do ferro: 0,11 cal/g°C.
Em um experimento, é fornecido calor a uma substância, inicialmente no estado sólido, que promove seu aquecimento e mudança de estado físico. O calor de vaporização da substância vale 200 cal.g -1. O gráfico do calor recebido em função da temperatura da substância é mostrado na Figura abaixo.

O calor específico dessa substância no estado líquido, em cal.g-1.°C-1, é, aproximadamente,
Um bloco plano de espessura ΔL0 é composto por um material homogêneo e isotrópico. Se a diferença de temperatura entre duas superfícies paralelas do bloco é ΔT0, tem-se um fluxo de calor entre essas superfícies dado por Q'0.
Se o material que forma o bloco for substituído por outro com as mesmas dimensões, mas com apenas 40% de sua condutividade térmica, ao observar-se o mesmo fluxo de calor, a nova diferença de temperatura entre as superfícies do bloco será
Uma lâmpada incandescente consiste de um filamento no vácuo. Em condições normais de funcionamento o filamento tem uma temperatura de 1600 K. Outra lâmpada com um filamento similar, que está em um bulbo preenchido com gás, tem o filamento com temperatura de 3200 K. Considere que ambos os filamentos, neste processo, se comportam como corpos negros. Analisando-se os espectros das radiações emitidas pelo filamento no vácuo e pelo filamento no ar, respectivamente, verifica-se que a razão entre os comprimentos de onda nos quais as intensidades das radiações são máximas é de
Considere que duas substâncias, A e B, de massas respectivas m A e mB e calores específicos cA e cB, são colocadas em contato térmico sob condições em que a pressão é mantida constante. Considerando que, nesta pressão, os calores específicos e as massas das substâncias obedecem à relação mAcA = 3 mBcB e que antes do contato cada substância estava à temperatura TA e TB, respectivamente, pode-se afirmar que a temperatura final Tf após o equilíbrio térmico ser alcançado, é
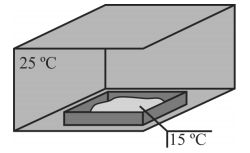
Um material que sofre transição da fase sólida diretamente para a fase gasosa quando submetido à temperatura de 20 º C foi inserido, a uma temperatura inicial de 15 ºC, em um ambiente fechado mantido à temperatura constante de 25 ºC, conforme ilustrado na figura anterior.
Assinale a opção que representa graficamente o comportamento da temperatura, T, em função do calor, Q, absorvido do meio por esse material a partir do momento em que foi inserido no ambiente descrito.

A figura precedente representa dois blocos A e B com massas iguais a 6 kg e 4 kg, respectivamente, inicialmente em repouso e ligados por um fio ideal (sobre uma roldana igualmente ideal). O coeficiente de atrito entre A e o plano horizontal vale 0,4 e a aceleração da gravidade vale 10 m/s 2.
Com base nas informações apresentadas e assumindo que toda a energia dissipada pela força de atrito foi usada para aquecer o corpo A, julgue o item a seguir.
Se o corpo A é feito de material que apresenta calor específico igual a 378 J/kgºC (Cobre), então, após ele ter sido arrastado por 1cm, sua temperatura terá aumentado em mais de 0,1 milésimos de Kelvins.
Acerca das afirmações A1, A2 e A3 abaixo é CORRETO afirmar:
A1- Considere que um cilindro de cobre de massa M, à temperatura de 80 ºC, é completamente mergulhado em água, a 20 ºC, contida num recipiente isolante de calor. Considere que a massa de água é igual à massa do cilindro de cobre. Sabendo que o calor específico da água é cerca de 10 vezes maior que o do cobre, a temperatura de equilíbrio da água será de 50 ºC.
A2- A quantidade de calor necessária para elevar a temperatura de um gás ideal em 1 ºC é menor sob pressão constante do que sob volume constante.
A3- A pressão de um gás ideal em um container de volume constante é proporcional à energia cinética média das moléculas do gás.
Os estados da matéria representam a forma em que um elemento se encontra a uma determinada temperatura e pressão. São cinco os estados físicos da matéria aceitos pelos cientistas atuais: o sólido, o líquido, o gasoso, o plasma e o condensado de Bose-Einstein. Sobre o estado sólido, analise as afirmativas abaixo e assinale a alternativa correta.
I. Os sólidos conservam sua forma, porém não conservam seu volume ao longo do tempo – vide o caso do gelo.
II. A diferença entre os estados físicos está na forma de organização das moléculas, quanto maior a agitação molecular, mais organizada é a estrutura cristalina.
III. Sólidos mantém suas partículas constituintes dispostas em um arranjo interno regularmente ordenado.
IV. O arranjo interno das moléculas ou átomos é chamado retículo cristalino ou estrutura cristalina.
V. A passagem do estado sólido para o estado líquido chama-se fusão e a passagem do estado sólido para o gasoso chama-se sublimação.
Assinale a alternativa que contém as afirmações verdadeiras:
Em um laboratório, 300 g de gelo que se encontra a -10 ºC deverá
ser transformado em água a +50 ºC. Considerando o calor latente
de fusão do gelo igual a 80 cal/g, o calor específico do gelo
igual a 0,5 cal/g ºC e o calor específico da água igual a 1 cal /g ºC,
julgue os itens subsequentes.
Para que todo o gelo a -10 ºC se transforme em água a 0 ºC
são necessárias 24.000 cal.
Em um laboratório, 300 g de gelo que se encontra a -10 ºC deverá
ser transformado em água a +50 ºC. Considerando o calor latente
de fusão do gelo igual a 80 cal/g, o calor específico do gelo
igual a 0,5 cal/g ºC e o calor específico da água igual a 1 cal /g ºC,
julgue os itens subsequentes.
A quantidade de calor necessária para que todo o gelo derreta
e se transforme em água a 0 ºC é inferior a 1.000 cal.
Em um laboratório, 300 g de gelo que se encontra a -10 ºC deverá
ser transformado em água a +50 ºC. Considerando o calor latente
de fusão do gelo igual a 80 cal/g, o calor específico do gelo
igual a 0,5 cal/g ºC e o calor específico da água igual a 1 cal /g ºC,
julgue os itens subsequentes.
A quantidade total de calor necessária para que todo o
gelo a -10 ºC se transforme em água a +50 ºC é maior
que 40.000 cal.
Quando a temperatura ambiente torna-se suficientemente baixa,
as águas dos lagos, dos rios e dos oceanos congelam a partir da
superfície. Assim, abaixo dessa camada superficial de gelo, a água
permanece na fase líquida. Isso permitiu, em uma era glacial
primitiva, a sobrevivência, no seio dessa água líquida, de seres
unicelulares que, evolutivamente, originaram todas as espécies
vivas.
São listadas, a seguir, três propriedades da água:
( ) tem uma dilatação anômala entre 0º C e 4º C;
( ) tem um calor específico muito elevado;
( ) é má condutora de calor.
Assinale R para a propriedade que é relevante para explicar esse
comportamento da substância água descrito acima e N para a
propriedade que não é relevante.

