Uma quantidade de gelo é aquecida do ponto de fusão (TF) até uma temperatura acima do ponto de ebulição da água (TE). O gráfico que melhor expressa a entropia S em função da temperatura T nesse processo é
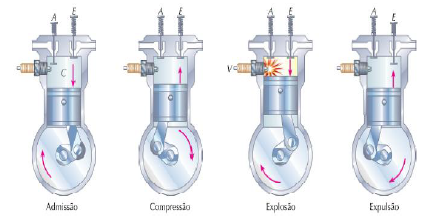
Um automóvel tem motor a explosão de quatro tempos (admissão, compressão, explosão, expulsão), conforme ilustrado na figura a seguir. Sobre este tema analise as afirmações abaixo:
I. O rendimento de uma máquina térmica ideal de Carnot depende do combustível utilizado.
II. O rendimento de uma máquina térmica ideal de Carnot será maior quando o quociente entre a temperatura da fonte fria e da fonte quente em Kelvin for menor.
III. O motor a explosão é capaz de transformar toda a energia produzida na combustão em trabalho útil.
IV. Considere um motor a explosão cujo ciclo a quatro tempos pode ser assim idealizado: O ciclo inicia em A e a mistura ar-combustível (admissão) é comprimida adiabaticamente até o ponto B (compressão). Em seguida, a mistura é aquecida isobaricamente até o ponto C e expandida adiabaticamente até o ponto D (explosão). Os gases gerados são então resfriados isocoricamente até A (expulsão). O digrama p x v (pressão x volume) que representa este ciclo é
Está correto o que se afirma em

A figura I mostra quatro fios condutores idênticos, de coeficiente de dilatação linear α, ligados na forma de um quadrado, e a figura II mostra uma chapa quadrada, de lado igual ao lado do quadrado da figura I, feito do mesmo material e homogêneo. Com base nessas informações, julgue o item a seguir.
Considerando que os dois objetos estejam inicialmente a uma mesma temperatura, se a temperatura de ambos for homogeneamente aumentada em ΔT graus Celsius, a área do quadrado feito de fios aumentará mais que a área da chapa quadrada.

A figura I mostra quatro fios condutores idênticos, de coeficiente de dilatação linear α, ligados na forma de um quadrado, e a figura II mostra uma chapa quadrada, de lado igual ao lado do quadrado da figura I, feito do mesmo material e homogêneo. Com base nessas informações, julgue o item a seguir.
Sabe-se que, no processo de dilatação do objeto quadrado homogêneo, sua entropia necessariamente aumenta.
Em um experimento, é fornecido calor a uma substância, inicialmente no estado sólido, que promove seu aquecimento e mudança de estado físico. O calor de vaporização da substância vale 200 cal.g -1. O gráfico do calor recebido em função da temperatura da substância é mostrado na Figura abaixo.

O calor específico dessa substância no estado líquido, em cal.g-1.°C-1, é, aproximadamente,
Um bloco plano de espessura ΔL0 é composto por um material homogêneo e isotrópico. Se a diferença de temperatura entre duas superfícies paralelas do bloco é ΔT0, tem-se um fluxo de calor entre essas superfícies dado por Q'0.
Se o material que forma o bloco for substituído por outro com as mesmas dimensões, mas com apenas 40% de sua condutividade térmica, ao observar-se o mesmo fluxo de calor, a nova diferença de temperatura entre as superfícies do bloco será
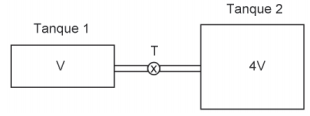
Dois tanques fechados de volumes V e 4V estão conectados por meio de um tubo de volume desprezível provido de uma válvula T, inicialmente fechada, como mostra a Figura abaixo.
Inicialmente, o tanque 1 contém 1,40 mol de ar a 1,50 atm, o tanque 2 contém 0,700 mol de ar, e todo o sistema está em equilíbrio térmico com a vizinhança. Considere o ar um gás ideal. A válvula então é aberta. Após um tempo, o sistema atinge novamente a temperatura inicial.
Nessa situação final, a pressão no tanque 1, em atm, será, aproximadamente, de
Uma lâmpada incandescente consiste de um filamento no vácuo. Em condições normais de funcionamento o filamento tem uma temperatura de 1600 K. Outra lâmpada com um filamento similar, que está em um bulbo preenchido com gás, tem o filamento com temperatura de 3200 K. Considere que ambos os filamentos, neste processo, se comportam como corpos negros. Analisando-se os espectros das radiações emitidas pelo filamento no vácuo e pelo filamento no ar, respectivamente, verifica-se que a razão entre os comprimentos de onda nos quais as intensidades das radiações são máximas é de
Um sistema termodinâmico pode passar do estado A ao estado B através de dois processos I e II mostrados no diagrama PV a seguir.
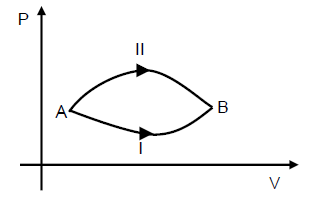
Se ΔUI,ΔUII são as variações de energia interna e ΔWI, ΔWII são os trabalhos realizados pelo sistema nos processos I e II, respectivamente,
Considere que duas substâncias, A e B, de massas respectivas m A e mB e calores específicos cA e cB, são colocadas em contato térmico sob condições em que a pressão é mantida constante. Considerando que, nesta pressão, os calores específicos e as massas das substâncias obedecem à relação mAcA = 3 mBcB e que antes do contato cada substância estava à temperatura TA e TB, respectivamente, pode-se afirmar que a temperatura final Tf após o equilíbrio térmico ser alcançado, é
Um pequeno aquecedor elétrico de imersão de 200 watts de potência foi usado para aquecer 240g de água durante 4 minutos. A variação da temperatura dessa quantidade de água, neste intervalo de tempo foi de:
(Dados: Calor específico da água igual a 1 cal/g°C, 1 cal = 4 J).
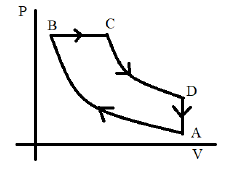
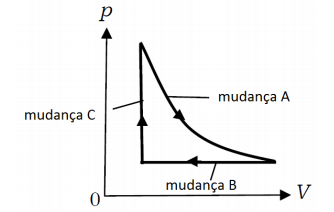
O gráfico abaixo representa a mudança de um gás, num processo reversível. É CORRETO afirmar:

A figura I mostra quatro fios condutores idênticos, de coeficiente de dilatação linear α, ligados na forma de um quadrado, e a figura II mostra uma chapa quadrada, de lado igual ao lado do quadrado da figura I, feito do mesmo material e homogêneo. Com base nessas informações, julgue o item a seguir.
O aumento da temperatura em qualquer um dos sistemas é fruto do aumento desordenado das velocidades de seus átomos.
Em meados do século XVIII o conceito de calor especifico e de calor latente não estavam ainda formulados, tarefa que foi resolvida entre 1761 e 1772 com trabalhos dos físicos Joseph Black e Johan Carl Wilcke. Por volta de 1749 predominava a expectativa de que a temperatura de equilíbrio térmico sempre estaria na proporção das massas ou dos volumes das substâncias, sem menção à essa característica intrínseca dos materiais.

Em experimentos de calorimetria são comuns desvios sensíveis entre valores observados e calculados com modelos ideais. Considerando o experimento de Black narrado por Bassalo segundo o modelo ideal em que há apenas trocas de calor entre a água, calor específico de 1 cal/g°C, e o gelo, calor latente de fusão de 80 cal/g, assinale a alternativa que representaria a expectativa teórica ideal.
O consumo energético primário da humanidade (energia extraída das fontes entre elas, por exemplo, petróleo, carvão, gás e fontes renováveis) é estimado hoje estar por volta de 500EJ por ano (E, exa, 1018). Por sua vez a energia solar total irradiada anualmente sobre o planeta terra é de cerca de 4x106 EJ.
Em caráter de comparação de escala, se utilizássemos cada uma dessas duas quantidades anuais de energia separadamente (consumo primário da humanidade e solar) para aquecer idealmente toda a água disponível na Terra, de cerca de 1 x 109 km3 (considerando que estivesse em estado líquido com calor específico de 4J/g°C, densidade d=1000kg/m3 ), a elevação da temperatura da água seria da ordem de: