O flúor é usado de forma ampla na prevenção de
cáries. Por reagir com a hidroxiapatita [Ca10(PO4)6(OH)2] presente nos esmaltes dos dentes, o flúor forma a
fluorapatita [Ca10(PO4)6F2], um mineral mais resistente
ao ataque ácido decorrente da ação de bactérias
específicas presentes nos açúcares das placas que
aderem aos dentes.
Disponível em: http://www.odontologia.com.br. Acesso em: 27 jul. 2010 (adaptado).
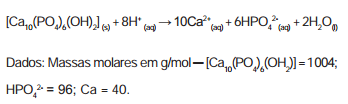
A reação de dissolução da hidroxiapatita é:
Supondo–se que o esmalte dentário seja constituído
exclusivamente por hidroxiapatita, o ataque ácido que
dissolve completamente 1 mg desse material ocasiona
a formação de, aproximadamente,
Fator de emissão (carbon footprint) é um termo utilizado
para expressar a quantidade de gases que contribuem
para o aquecimento global, emitidos por uma fonte
ou processo industrial específico. Pode–se pensar na
quantidade de gases emitidos por uma indústria, uma
cidade ou mesmo por uma pessoa. Para o gás CO2,
a relação pode ser escrita:
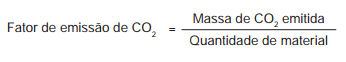
O termo “quantidade de material" pode ser, por exemplo,
a massa de material produzido em uma indústria ou a
quantidade de gasolina consumida por um carro em um
determinado período.
No caso da produção do cimento, o primeiro passo é a
obtenção do óxido de cálcio, a partir do aquecimento do
calcário a altas temperaturas, de acordo com a reação:
CaCO3(s) → CaO(s) + CO2(g)
Uma vez processada essa reação, outros compostos
inorgânicos são adicionados ao óxido de cálcio, tendo o
cimento formado 62% de CaO em sua composição.
Dados: Massas molares em g/mol — CO(s) = 44;
CaCO3 = 100; CaO = 56.
TREPTOW, R. S. Journal of Chemical Education. v. 87 nº 2, fev. 2010 (adaptado).
Considerando as informações apresentadas no texto,
qual é, aproximadamente, o fator de emissão de CO2
quando 1 tonelada de cimento for produzida, levando–se
em consideração apenas a etapa de obtenção do óxido
de cálcio?

Segundo as condições do processo apresentado para a obtenção de carbonato de chumbo (II) por meio da lixiviaçao por carbonato de sódio e considerando uma massa de pasta residual de uma bateria de 6 kg, qual quantidade aproximada, em quilogramas, de PbCO3 é obtida?
Para se obter 1,5 kg do dióxido de urânio puro, matériaprima para a produção de combustível nuclear, é necessário extrair-se e tratar-se 1,0 tonelada de minério. Assim, o rendimento (dado em % em massa) do tratamento do minério até chegar ao dióxido de urânio puro é de
Texto para as questões 17 e 18. Na investigação forense, utiliza-se luminol, uma substância que reage com o ferro presente na hemoglobina do sangue, produzindo luz que permite visualizar locais contaminados com pequenas quantidades de sangue, mesmo em superfícies lavadas. É proposto que, na reação do luminol (I) em meio alcalino, na presença de peróxido de hidrogênio (II) e de um metal de transição (Mn+), forma-se o composto 3-amino ftalato (III) que sofre uma relaxação dando origem ao produto final da reação (IV), com liberação de energia (hν) e de gás nitrogênio (N2). (Adaptado. Química Nova, 25, no 6, 2002. pp. 1003-1011.)
Na análise de uma amostra biológica para análise forense, utilizou-se 54 g de luminol e peróxido de hidrogênio em excesso, obtendo-se um rendimento final de 70%. Sendo assim, a quantidade do produto final (IV) formada na reação foi de
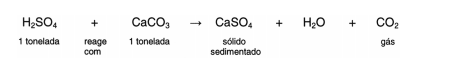
Em setembro de 1998, cerca de 10.000 toneladas de ácido sulfúrico (H2SO4) foram derramadas pelo navio Bahamas no litoral
do Rio Grande do Sul. Para minimizar o impacto ambiental de um desastre desse tipo, é preciso neutralizar a acidez resultante.
Para isso pode-se, por exemplo, lançar calcário, minério rico em carbonato de cálcio (CaCO3), na região atingida.
A equação química que representa a neutralização do H2SO4 por CaCO3, com a proporção aproximada entre as massas
dessas substâncias é:
Pode-se avaliar o esforço de mobilização que deveria ser empreendido para enfrentar tal situação, estimando a quantidade de
caminhões necessária para carregar o material neutralizante. Para transportar certo calcário que tem 80% de CaCO3, esse
número de caminhões, cada um com carga de 30 toneladas, seria próximo de
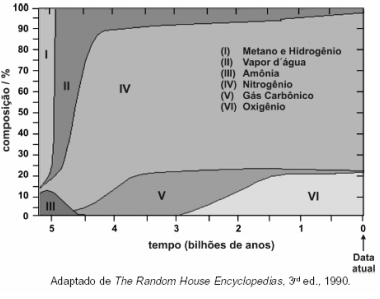
No que se refere à composição em volume da atmosfera terrestre há 2,5 bilhões de anos, pode-se afirmar que o volume de oxigênio, em valores percentuais, era de, aproximadamente,
Atualmente, sistemas de purificação de emissões poluidoras estão sendo exigidos por lei em
um número cada vez maior de países. O controle das emissões de dióxido de enxofre
gasoso, provenientes da queima de carvão que contém enxofre, pode ser feito pela reação
desse gás com uma suspensão de hidróxido de cálcio em água, sendo formado um produto
não poluidor do ar.
A queima do enxofre e a reação do dióxido de enxofre com o hidróxido de cálcio, bem como
as massas de algumas das substâncias envolvidas nessas reações, podem ser assim
representadas:
enxofre (32 g) + oxigênio (32 g) → dióxido de enxofre (64 g)
dióxido de enxofre (64 g) + hidróxido de cálcio (74 g) → produto não poluidor
Dessa forma, para absorver todo o dióxido de enxofre produzido pela queima de uma
tonelada de carvão (contendo 1% de enxofre), é suficiente a utilização de uma massa de
hidróxido de cálcio de, aproximadamente,
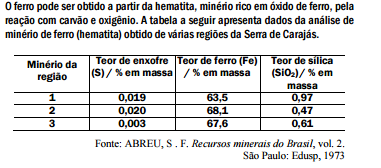
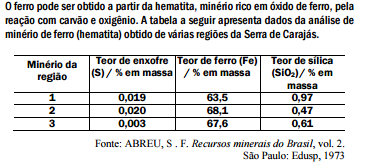
No processo de produção do ferro, a sílica é removida do minério por reação
com calcário (CaCO3). Sabe-se, teoricamente (cálculo estequiométrico), que
são necessários 100 g de calcário para reagir com 60 g de sílica.
Dessa forma, pode-se prever que, para a remoção de toda a sílica presente em
200 toneladas do minério na região 1, a massa de calcário necessária é,
aproximadamente, em toneladas, igual a:
No processo de produção do ferro, dependendo do minério utilizado, forma-se
mais ou menos SO2, um gás que contribui para o aumento da acidez da chuva.
Considerando esse impacto ambiental e a quantidade de ferro produzida, podese
afirmar que seria mais conveniente o processamento do minério da(s)
região(ões):