O gás dióxido de enxofre (SO 2) é um dos principais e mais perigosos poluentes ambientais. No Brasil, é usado pelo Conselho Nacional de Meio Ambiente (Conama) como um importante indicador do padrão nacional de qualidade do ar (Resolução CONAMA nº 03, de 28/06/90). Para a adequada interpretação dos dados analíticos na determinação das concentrações de SO2 no ar atmosférico, frequentemente é necessária a conversão de quantidade de matéria presente no ar atmosférico em quantidade de mols. Assim, assinale a alternativa que indica, para uma amostra de ar atmosférico contendo 8g de SO2, aproximadamente, a quantidade de moléculas de SO2 presentes, assim como o número de mols de SO2, respectivamente.
(Dados: número de Avogadro=6,02x1023 ; massa atômica O=16, S=32)
Analise as reações químicas representadas a seguir acerca da aplicação do método de Mohr na determinação de Cl-1 em água do mar, em diferentes valores de pH. A respeito do balanceamento químico dessas reações, assinale a alternativa que apresenta a soma dos valores corretamente atribuídos a: x,y,k,z,w.
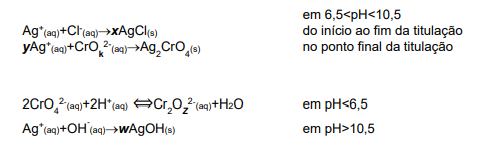
Com base nas estruturas químicas fornecidas a seguir (I a V), analise as proposições abaixo.
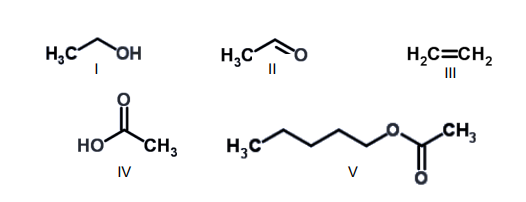
1) As estruturas I e II apresentam mesma forma molecular (C2H6O) e pertencem à mesma classe de substâncias orgânicas.
2) O composto orgânico III corresponde a um hidrocarboneto insaturado, e apresenta menos átomos de hidrogênio por carbono que o seu alcano correspondente.
3) O grupo funcional encontrado na molécula IV é chamado de carboxila, e corresponde à combinação de uma carbonila e uma hidroxila.
4) Na molécula V, o grupamento carbonila está presente, e caracteriza esse grupo de compostos orgânicos, denominados éteres.
Está(ão) correta(s), apenas:
Analise o texto a seguir, a respeito do funcionamento básico de um equipamento rotineiramente usado em laboratório de química. A qual equipamento o texto se refere?

A reciclagem de resíduos gerados nos laboratórios de química é importante para a manutenção adequada do meio ambiente. Nesse contexto, assinale a alternativa que apresenta a técnica mais adequada para a separação/purificação de misturas de dois ou mais solventes orgânicos miscíveis, de pontos de ebulição próximos.
Na indústria, o densímetro é frequentemente usado na caracterização de diferentes materiais. A respeito dos densímetros e seus usos, assinale V para as afirmações verdadeiras, ou F para as falsas.
( ) O densímetro é frequentemente usado na exata identificação e caracterização de diferentes materiais, pois a densidade é uma propriedade específica de cada substância.
( ) Como a densidade varia diretamente com a temperatura e pressão, seu valor é dado em função dessas outras grandezas.
( ) A densidade não varia com o volume ocupado por determinada massa. Assim, amostras muitos concentradas apresentam a mesma densidade que aquelas diluídas, nas mesmas condições de temperatura e pressão.
( ) O alcoômetro é um tipo específico de densímetro usado para medir o teor do álcool etílico em misturas hidroalcoólicas, sob temperatura pré-definida.
A sequência correta, de cima para baixo, é:
Analise a equação e as afirmações a seguir, a respeito dos fatores que afetam o equilíbrio de solubilidade e a cinética química das reações. Assinale V para as afirmações verdadeiras, ou F para as falsas.
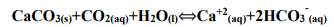
( ) Se a água subterrânea contendo dióxido de carbono (CO2) dissolvido entrar em contato com calcário (CaCO3), à baixa pressão (ex. no interior de uma caverna), mais CaCO3 é dissolvido.
( ) Se a água subterrânea contendo dióxido de carbono (CO2) dissolvido gotejar sobre o calcário (CaCO3), à alta pressão (ex. em regiões de águas profundas), CaCO3 permanece no estado sólido (ex. na forma de estalactites e estalagmites).
( ) Se a água do mar contendo dióxido de carbono (CO2) dissolvido entrar em contato com o calcário (CaCO3), a altas temperaturas (ex. regiões de mar quente), CaCO3 permanece no estado sólido (ex. na forma de corais).
( ) Se a água do mar contendo dióxido de carbono (CO2) dissolvido entrar em contato com o calcário (CaCO3), a baixas temperaturas (ex. regiões de mar frio), mais CaCO3 é dissolvido.
A sequência correta, de cima para baixo, é:
A oxigenoterapia consiste na administração suplementar de oxigênio (O2) gasoso a um paciente, com o objetivo de elevar ou manter a saturação de oxigênio aos níveis aceitáveis, corrigindo uma possível deficiência no aporte de oxigênio aos tecidos nesse indivíduo. A quantidade de oxigênio a ser administrada é medida em função do teor de oxigênio no paciente, e as informações sobre a quantidade de mols de O2 são necessárias para a correta aplicação da técnica. A esse respeito, assinale a alternativa que apresenta aproximadamente o número de mols de oxigênio em uma amostra contendo 1,20x1021 moléculas de O2.
(Dados: número de Avogadro=6,02x1023)
Questão anterior:

Ainda a respeito da produção de amônia, conforme reação apresentada anteriormente (questão 52), assinale a alternativa que apresenta, respectivamente, quantas moléculas de H2(g) serão consumidas na reação, considerando que foram consumidas 3,60x1020 moléculas de N2(g), e quantos mols de NH3(g) serão produzidos, se forem empregados 1,2mols de N2.
O ácido clorídrico com a denominação PA (Padrão Analítico) é comercializado em solução a 37%. Por ser um ácido forte, que origina soluções diluídas estáveis, é frequentemente empregado em análises titrimétricas. Para conhecer a real concentração do HCl nas soluções empregadas, torna-se necessário o procedimento de padronização das mesmas. Assinale a alternativa que apresenta uma substância que pode ser empregada como padrão primário para a padronização do HCl, e a justificativa para sua escolha.

