
Texto 8A1-II
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa reação apresentem comportamento ideal e que a lei de velocidade para a reação seja dada pela equação v = k × [SO2Cl2]. Considere também que, na temperatura em que a reação ocorre (T), a constante de equilíbrio (Keq) da reação valha 0,40.
De acordo com a reação apresentada no texto 8A1-II, o tempo de meia vida (t1/2) do SO2Cl2 (g), entendido como o período de tempo necessário para que a concentração da espécie caia à metade da concentração inicial, pode ser calculado por meio da expressão
A combustão do metanol, combustível usado nos carros da Fórmula Mundial, produz uma chama invisível a olho nu, que libera ondas na faixa
A Lei n.º 14.238, de 19 de novembro de 2021, instituiu o Estatuto de Pessoa com Câncer, que estendeu à pessoa com câncer clinicamente ativo o direito à prioridade equivalente a várias garantias concedidas aos idosos, às gestantes e às pessoas com deficiência. Seus objetivos incluem reduzir a incidência da doença por meio de ações de prevenção e fomentar a criação e o fortalecimento de políticas públicas de prevenção e combate ao câncer.
Considerando esse contexto, sabe-se que o número de compostos comprovadamente carcinógenos para os seres humanos é muito pequeno. Em alguns casos, os compostos químicos são considerados carcinógenos com base em estudos epidemiológicos com humanos expostos. Um exemplo bem documentado é o cloreto de vinila, que possui a seguinte fórmula:
Considerando que o ponto de equivalência de uma titulação corresponde ao ponto estequiométrico, ou seja, o momento em que a quantidade de matéria do titulante se iguala à quantidade de matéria do titulado. O ponto final de uma titulação, por sua vez, pode ser corretamente definido como o momento em que
Considere que, em um recipiente de 2 L, esteja acontecendo a reação química ilustrada no gráfico a seguir.
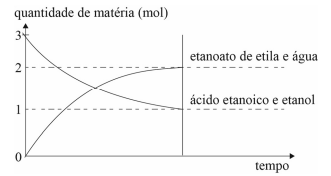
Nesse caso, a constante de equilíbrio da reação em apreço é igual a
Caso se deseje aquecer uma amostra de gás natural,
Texto 8A1-II
O SO2Cl2 (g) decompõe-se facilmente de acordo com aequação:
SO2Cl2 (g) ⇌ SO2 (g) + Cl2 (g) ΔH > 0
Por esse motivo, ele é muito empregado como fonte deCl2 (g) em reações químicas.
Considere que todas as espécies gasosas envolvidas nessa reação apresentem comportamento ideal e que a lei de velocidade para a reação seja dada pela equação v = k × [SO2Cl2]. Considere também que, na temperatura em que a reação ocorre (T), a constante de equilíbrio (Keq) da reação valha 0,40.
Considerando-se as informações do texto 8A1-II, se, inicialmente, houver SO2Cl2 (g) à pressão parcial inicial de 1,50 bar em um sistema fechado isento de SO2 (g) e Cl2 (g), então a pressão parcial do SO2Cl2 (g), quando atingido o equilíbrio químico à temperatura T, será igual a
O número de oxidação (nox) deve ser determinado para cada átomo isoladamente. Os metais alcalinoterrosos, que apresentam nox igual a +2, incluem
Segundo a teoria de Brönsted-Lowry, um ácido
O ácido oxálico pode ser titulado com uma solução de permanganato de potássio (KMnO4), por meio da seguinte reação.
3 C2H2O4 + 2 MnO4 − ⇌ CO3 2− + 2 MnO2 + 3 H2O + 5 CO2
Considere que, na titulação de 10 mL de uma solução de ácido oxálico pelo método descrito anteriormente, tenham sido consumidos 25 mL de uma solução de KMnO4 0,0100 mol/L. Nesse caso, a concentração em quantidade de matéria de ácido oxálico na solução-problema é de
A equação seguinte representa a reação de decomposição da água.
H2O (g) ⇌ H2 (g) + 1/2 O2 (g)
Considere que, em um recipiente de 5 L, tenham sido adicionados 225 g de água e, em seguida, esse sistema tenha sido aquecido a 2.000 °C, sob pressão de 1 atm. Assumindo-se que, nesse caso, 70% da água será decomposta e que a massa molar da água (MH20) é igual a 18,0 g/mol, é correto afirmar que a concentração de água remanescente, após a situação de equilíbrio, será de
Um tanque foi carregado com determinada quantidade de gás natural comprimido à temperatura ambiente e, ao se medir a pressão no tanque, verificou-se que ela era consideravelmente menor que a esperada de acordo com a lei dos gases ideais para a temperatura em questão.
Nessa situação, o comportamento descrito deve-se
Em uma expansão isotérmica reversível, à temperatura T, de n mols de um gás ideal desde um volume inicial de 10 L até um volume final de 20 L, se R representa a constante universal dos gases, então a variação de entropia (ΔS) do sistema pode ser corretamente calculada por meio da expressão
Considerando a estrutura dos compostos orgânicos, os três principais postulados de Couper-Kekulé preveem que o átomo de carbono é

