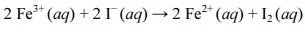A respeito da reação de oxirredução balanceada apresentada anteriormente, é correto afirmar que

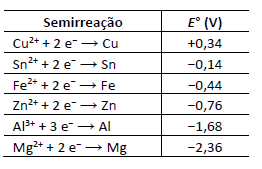
Tratando-se de reações de oxirredução, observe as semirreações a seguir:
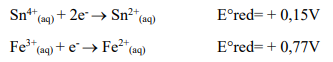
Considerando as semirreações, é CORRETO afirmar que a equação global balanceada da reação espontânea será:
Observe a pilha representada na imagem e baseado nos seus conhecimentos de eletroquímica julgue a veracidade das informações abaixo:
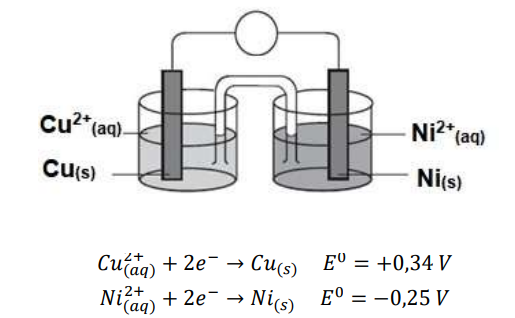
I. A região que sofre redução é o cátodo.
II. A placa de cobre que atua com ânodo e sofre corrosão.
III. O fluxo de elétrons do sistema vai da placa cobre para a placa de níquel
As afirmações verdadeiras são:
“A multiplicação de uma meia-reação por qualquer número não modifica o valor do potencial-padrão de redução, E°.” Esta afirmação está correta porque
Nos eletrodos comerciais de vidro combinado, normalmente utilizados nas determinações de pH de soluções aquosas, são utilizados como eletrodo indicador e eletrodo de referência, respectivamente:
Com relação à potenciometria, marque a alternativa incorreta.
A proteção catódica é um método utilizado para a proteção de estruturas. Com isso, tubulações e tanques de estocagem, entre outros, são protegidos por esse método. Em uma aula de química, deseja‐se estudar a proteção da corrosão de um equipamento constituído basicamente por ferro, empregando‐se o método da proteção catódica com o uso de um metal de sacrifício. Nesse contexto, a tabela a seguir mostra os potenciais‐padrão de redução (E°) de algumas espécies.
Com base nesse caso hipotético, assinale a alternativa que apresenta um metal de sacrifício adequado e a explicação correta de seu funcionamento.
Considere os seguintes potenciais de redução, a 25,0 °C:
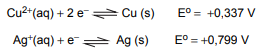
Quando um fio de cobre (Cu) é imerso numa solução aquosa de nitrato de prata (AgNO3), ocorre uma reação de óxido redução devido a
Acerca de eletroquímica e de processos de oxidação e redução, julgue o item a seguir.
As espécies capazes de fixar elétrons são agentes redutores e as capazes de doar elétrons são agentes oxidantes. Um agente redutor age recebendo elétrons de uma espécie. Com isso, ele reduz essa espécie e ele próprio é oxidado.
Em potenciometria, os eletrodos indicadores devem apresentar a seguinte característica:
A massa de cobre metálico, em gramas, que será depositada no cátodo de uma célula eletrolítica contendo solução de CuSO 4, submetida a uma corrente de 2,0 Amperes, durante 10 minutos, considerando rendimento eletrolítico de 100%, é igual a
Com base nos conceitos de eletroquímica e de radioquímica,
julgue os próximos itens.
Eletroquímica é o ramo da química que trata do uso de reações químicas para produzir eletricidade, das forças relativas dos agentes oxidantes e redutores e do uso da eletricidade para produzir mudança química.
O escurecimento de objetos de prata, como baixelas e talheres, é muito comum. Ao se cozinhar demasiadamente os ovos, as proteínas da clara, que contêm átomos de enxofre, liberam o ácido sulfídrico, que na forma gasosa e na presença de oxigênio, na água de cozimento, pode levar à oxidação do objeto de prata, com formação de uma fina camada insolúvel de sulfeto de prata (Ag 2S). O mesmo ocorre quando se cozinham alimentos como o repolho, que contém compostos sulfurados como a cisteína, estrutura representada na figura, que sofre decomposição durante o cozimento, liberando o H2S. As principais reações envolvidas nesse fenômeno são apresentadas nas equações:
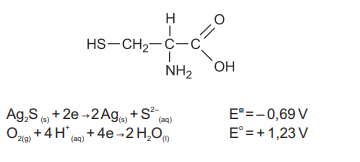
A diferença de potencial (ddp) para a reação global que representa o fenômeno do escurecimento dos objetos de prata tem valor igual a:
A corrosão externa é uma das grandes causas de vazamento em tubulações e reservatórios. Pinturas e revestimentos ajudam a minimizar esse desgaste. A galvanização consiste em uma proteção eficiente para tubulações de aço, onde uma camada de zinco é aplicada sobre a superfície da liga metálica. Essa camada atua como uma barreira, minimizando a ação da água e do oxigênio sobre o aço.
Sobre a galvanização, afirma-se que
A corrosão é resultado da ação do meio sobre um determinado material, causando sua deterioração. A formação da ferrugem se caracteriza por ser um processo de corrosão do ferro, onde os átomos de ferro sofrem oxidação, perdendo elétrons. A aplicação de uma camada de outro metal sobre o ferro o protege da oxidação.
Considere as reações de redução e os respectivos potenciais apresentados a seguir.
O elemento que seria útil para a proteção do ferro é o