O professor de Ciências queria montar um experimento para que
os alunos pudessem entender que a combustão produz gás
carbônico. Para essa finalidade, dispunha de três potes iguais,
que poderiam ser emborcados sobre uma mesma quantidade de
água de cal incolor, conforme a figura a seguir:
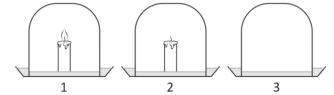
Considerando que os alunos já sabiam que a água de cal incolor
ficava esbranquiçada quando em contato com o gás carbônico
(CO2), o melhor experimento para verificar se a combustão
produz gás carbônico deveria conter
Os investigadores podem encontrar impressões digitais em objetos borrifando solução da substância X, que, ao entrar em contato com a substância Y, deixada no objeto pela pessoa que tocou nele anteriormente, reage, produzindo Z, uma substância branca que, quando exposta à luz solar, escurece, revelando as linhas das impressões digitais.
http://pibid-bio-uepg.blogspot.com/2013/08/as-funcoes-inorganicas-esua.html. Acesso em 09/06/2020. Adaptado.
A reação química descrita é:
AgNO3 + NaCl → AgCl + NaNO3
As substâncias X, Y e Z, descritas no texto, são denominadas, respectivamente,
Um método utilizado para determinar a concentração de ozônio (O3) no ar é passar uma amostra de ar por um borbulhador contendo solução aquosa de iodeto de sódio (NaI). A reação química que ocorre é descrita a seguir.
O3( g) + 2 NaI (aq) + H2O () O2 (g) + I2 (s) + 2 NaOH (aq)
Ao passar uma amostra de ar por um borbulhador, verificou-se o consumo de 1,5 mg de iodeto de sódio. A massa de ozônio, em mg, presente nessa amostra era de
[Massa Molares (g.mol–1): H = 1,0; I = 127,0; O = 16,0; Na = 23,0]
Para que os alunos verificassem a composição química de alguns
alimentos, o professor distribuiu seis diferentes tipos de
alimentos numerados, pedindo que os submetessem aos
seguintes testes:
I.esfregassem cada um deles sobre um papel absorvente; e
II.Pingassem uma gota de iodo diluído sobre cada um.
Os resultados desses testes foram registrados, de comum acordo
com a turma, no quadro.
A tabela a seguir mostra os resultados obtidos.
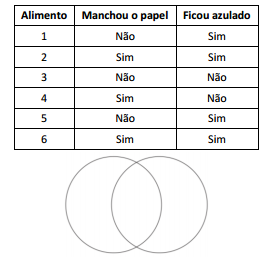
Em seguida, o professor pediu que os alunos escrevessem o
número dos alimentos que contivessem apenas gordura no
círculo da esquerda e, os que contivessem apenas amido, no
círculo da direita.
Na intercessão dos dois círculos deveriam ser colocados os
alimentos que contivessem gordura e amido. Para indicá-los, os
alunos deveriam escrever
O triângulo apresentado a seguir representa objetos de interesse
da Química, colocando no centro os materiais e substâncias e, em
cada um dos vértices, aspectos diferentes do conhecimento
químico com eles relacionados.
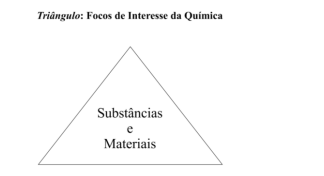
Segundo a proposta de MACHADO, (2014, p. 157) os vértices
desse triângulo devem corresponder aos seguintes aspectos:
A nitroglicerina é uma molécula altamente instável que explode se aquecida ou submetida a fortes impactos. Nesse processo são produzidas nuvens de gases, que se expandem rapidamente, além de intenso calor. A reação química (não balanceada) para esse fenômeno é descrita a seguir.
C3H5N3O9 (l) N2 (g) + CO2 (g) + H2O (g) + O2 (g)
A soma dos menores inteiros que balanceiam corretamente essa equação é igual a
A quantidade de matéria orgânica em águas superficiais e
residuais pode ser expressa por meio da demanda química de
oxigênio (DQO).
A principal reação para estimar o teor de material orgânico em
águas pode ser representada como:
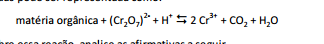
Sobre essa reação, analise as afirmativas a seguir.
I. A matéria orgânica é reduzida formando CO2.
II. O dicromato atua como agente oxidante.
III. O dicromato doa elétrons para a matéria orgânica formarCO2.
Está correto o que se afirma em
O fenômeno conhecido como chuva ácida causa efeitos extremamente nocivos ao ambiente como, por exemplo, alteração da vida aquática, danos à vegetação e corrosão de construções. A água da chuva não poluída já é naturalmente ácida (pH = 5,5) devido a sua interação com o gás carbônico atmosférico. No entanto, diversos países no mundo têm registrado severas alterações, chegando a níveis de pH médio anual para água da chuva em torno de 3,5.
Em comparação com a água da chuva não poluída, pode-se afirmar que a acidez média anual registrada por esses países é cerca de
A Química Forense surgiu a partir de um crime de grande repercussão cometido na Bélgica, em 1850. O criminoso teria extraído óleo de uma planta e obrigado a vítima a ingerir a substância. Para comprovar o crime, a polícia pediu ajuda a um químico, que desenvolveu um método para detectar a substância nos tecidos do cadáver, o que permitiu a condenação do criminoso.
ÂNGELIS, R. Descubra a importância da química forense. http://www.ung.br/noticias/descubra-importancia-da-quimica-forense. Acesso em 10/06/2020. Adaptado.
Dados: massas atômicas (u): H = 1, C = 12, N = 14 e O = 16.
A substância detectada possuía massa molecular 162; portanto, é possível saber que se tratava da
A atmosfera terrestre é formada por diversos compostos que
podem sofrer transformações químicas cujas velocidades
dependem de fatores tais como: concentração, temperatura,
catalisador e reatividade.
Alguns autores relacionam a capacidade de reagir e de atuar em
diferentes pontos da superfície terrestre como tempo de
residência. O quadro a seguir apresenta o tempo de residência de
alguns constituintes da atmosfera.
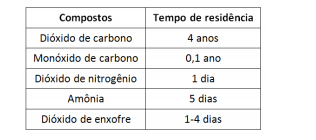
Considerando a hipótese desses compostos serem emitidos nas
mesmas condições e quantidades, e na mesma região geográfica,
assinale a opção que indica o composto que apresenta maior
capacidade de se espalhar pela atmosfera e atuar em regiões
mais distantes.
O primeiro hormônio sexual masculino a ser isolado foi a androsterona, uma variação metabolizada e menos potente que a testosterona, que é excretada pela urina. Como é possível observar na figura a seguir, há pouca diferença entre ambas as estruturas.
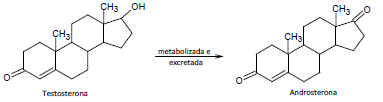
No processo de metabolização da testosterona em androsterona observa-se a conversão de um
Duas garrafas pet de 500 mL tiveram o fundo retirado e foram
encaixadas, formando um tubo, como mostrado na figura.
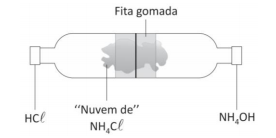
Em uma das tampas foi colocado um algodão embebido em ácido
clorídrico (HCL) e, na outra, um algodão embebido em hidróxido
de amônio (NH4OH). As tampas foram atarraxadas e, em alguns
segundos, os alunos foram surpreendidos com a formação de
uma “nuvem" esbranquiçada, próximo ao centro da montagem.
O professor explicou que a nuvem correspondia a uma espécie de
poeira de cloreto de amônio (NH4CL).
O experimento pode ser utilizado para demonstrar uma reação
de