A respeito das propriedades químicas e físicas de determinados combustíveis, julgue o próximo item.
A gasolina é uma substância orgânica que reage com o oxigênio do ar.
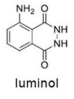
Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
Em 2 mols de moléculas de luminol, existem 14 × 1023 átomos de hidrogênio.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
O efeito da adição do catalisador ácido é o de reduzir a energia de ativação da reação e, com isso, aumentar a fração de colisões efetivas.
A precipitação de cátions metálicos pela adição de um ânion com o qual eles formem composto insolúvel é uma ferramenta bastante utilizada para a remoção, identificação e(ou) quantificação de um metal em solução. Por exemplo, a adição de uma solução de H 2S é empregada para promover a precipitação de sulfetos metálicos pouco solúveis.
Considerando que as constantes de ionização ácida do H
2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
A concentração de íons S2- em uma solução aquosa de H2S 0,100 mol/L é inferior a 1,0 × 10-10.
Existem diversas técnicas para a coleta de impressões digitais em cenas de crimes que estão relacionadas com a composição do suor. O suor, simplificadamente, é uma solução aquosa de eletrólitos. O Na+ é um dos eletrólitos encontrados no suor pela dissolução de sais, por exemplo, o cloreto de sódio, cuja entalpia de dissolução em água é igual a −3,8 kJ/mol. O sódio é do grupo 1, ou família 1A, e está no terceiro período da Tabela Periódica. Acerca desse assunto, julgue os itens a seguir.
A temperatura da água aumenta com a dissolução de NaCl.
Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
Considere que a reação entre antimônio e sulfeto produza o sal Sb
2S3, pouco solúvel e de cor ocre que, em meio aquoso, dissocia-se parcialmente, de acordo com o equilíbrio Sb2S3(s) X 2Sb3+(aq) + 3S2-(aq). Nesse caso, a concentração de sulfeto necessária para iniciar a formação do sólido Sb2S3 em uma solução aquosa de Sb3+ de concentração x mol/L deverá ser maior que 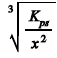
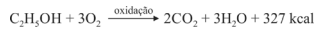
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, são liberados 88 g de CO2.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Por ser um ácido fraco, o ácido lático dissocia-se parcialmente em água, formando lactato e H+, até atingir um equilíbrio químico.
Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
Se, na queima de um artefato pirotécnico ocorrer a decomposição do carbonato de bário, de acordo com a reação química BaCO 3(s) → BaO(s) + CO2(g), então a entalpia padrão dessa reação de decomposição (ΔHx), calculada a partir dos dados listados na tabela seguinte, será ΔHx = ΔH1 - ΔH2 + ΔH3.

Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
O ferro presente na hemoglobina atua como catalisador na reação do luminol com o sangue.
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
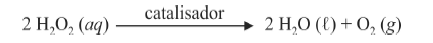
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
Em solução aquosa com pH igual a 10,0, o grau de ionização ácida do H2O2 é superior a 2,0%.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item que se segue.
Na alquimia, a transformação da matéria era discutida a partir de concepções filosóficas permeadas de misticismo.
O composto conhecido como luminol é empregado para a detecção de sangue em perícias criminais. Em meio básico, em presença de peróxido de hidrogênio (H 2O2) e de um catalisador adequado, o luminol é oxidado ao ânion 3-aminoftalato, o qual é obtido inicialmente em um estado excitado, mas que rapidamente libera o excesso de energia emitindo radiação na faixa do azul.
A oxidação do luminol é realizada pelo O 2 (g) formado a partir da decomposição do peróxido de hidrogênio (H2O2), de acordo com a equação:
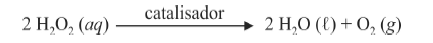
Sem a presença de um catalisador, a decomposição em questão é bastante lenta. Entretanto, o ferro presente na hemoglobina do sangue catalisa a decomposição e o O 2 (g) formado rapidamente oxida o luminol, ocasionando a característica luminescência azul.
Com relação à reação apresentada e às espécies nela envolvidas, e considerando a primeira constante de ionização ácida do H 2O2 igual a 2,4 × 10-12, julgue o item a seguir.
A quantidade de calor liberada por mol de moléculas de H2O2 decompostas é maior na reação realizada em presença do catalisador do que na reação não catalisada.

Considere as reações I, II e III a seguir.
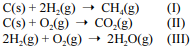
Com relação a essas informações, julgue o item que se segue.
De acordo com as leis das reações gasosas de Gay Lussac, sob mesma temperatura e pressão, o volume ocupado pelo CO2 é maior que o volume do O2 na reação II.
A seguir são apresentadas informações referentes à reação de decomposição do H 2O2.
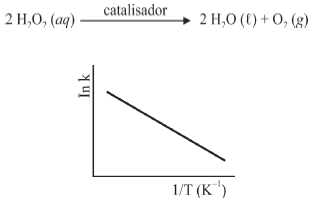
A figura precedente mostra o gráfico do logaritmo neperiano da constante de velocidade k da reação em função do recíproco da temperatura, sendo que a equação que descreve a reta obtida é y = 30 - 3,0 × 10 4 x.
Nas tabelas I e II são apresentadas, para uma temperatura de 25 ºC, as energias livres de Gibbs padrão de formação (ΔGº f) para as espécies envolvidas na reação e algumas entalpias padrão de ligação (Hº l), respectivamente.
Considerando que a reação de decomposição do H 2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1, julgue os itens subsequentes, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de equilíbrio da reação de decomposição do H2O2 é superior ao verificado em temperaturas mais baixas.
Um dispositivo analítico, conforme ilustrado na figura precedente, baseado em papel microfluídico (μPAD), foi desenvolvido para a determinação in loco da presença de chumbo, bário, antimônio, ferro, alumínio, zinco e magnésio, em resíduos de explosivos pirotécnicos. Cada canal contém um conjunto específico de reagentes que produz uma mudança de cor após a interação com um sal de metal específico, conforme esquematizado na tabela anterior. Esse novo dispositivo deve ser útil na detecção in loco de resíduos pós-explosão de pirotecnia no campo, devido à sua portabilidade e facilidade de uso.
Tendo como referência a figura e os dados da tabela precedentes, julgue o item a seguir
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Todo par ácido fraco/base conjugada pode agir mais eficientemente como tampão em valores de pH próximos à neutralidade (pH = 7).
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
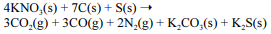
Acerca desse assunto, julgue o próximo item.
Sendo a pólvora formada somente por salitre, enxofre e carvão, na mesma proporção molar da reação apresentada, a queima de 10,0 g de pólvora produzirá mais de 3,0 g de sulfeto de potássio (K2S).
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
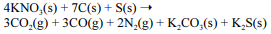
Acerca desse assunto, julgue o próximo item.
A equação apresentada desobedece ao princípio de Lavoisier, uma vez que a massa dos produtos é menor que a massa dos reagentes devido à presença de gases de baixa densidade formados pela reação.

Considerando as informações e a ilustração apresentadas, julgue o próximo item.
Com a destruição térmica pelo método de incineração, o peso, o volume e o potencial de periculosidade dos resíduos são reduzidos.
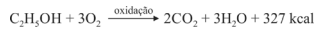
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de 109 kcal.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
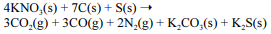
Acerca desse assunto, julgue o próximo item.
A massa molar do composto formado pelo ânion do carbonato de potássio e o cátion do nitrato de alumínio é maior que 250,0 g/mol.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
A adição do catalisador ácido faz que o equilíbrio da reação seja alcançado mais rapidamente; quando alcançado, o equilíbrio estará mais deslocado para o sentido dos produtos.
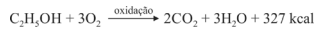
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
A massa de 1 mol de etanol é 46 g
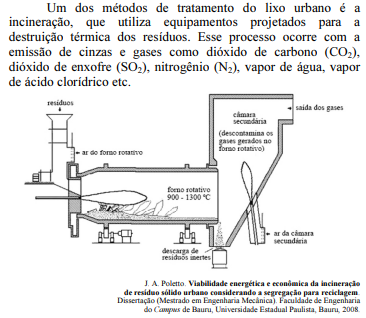
Considerando as informações e a ilustração apresentadas, julgue o próximo item.
Ao atingir a atmosfera, o SO2, em contato com a água, forma o ácido sulfuroso, que provoca a chuva ácida.
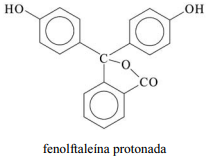
A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H
2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
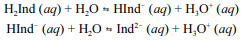
Uma vez que as espécies com diferentes graus de protonação apresentam cores diferentes, a coloração de uma solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
Considerando que a fenolftaleína seja incolor em pH reduzido e rosa em pH elevado, infere-se que a forma protonada da fenolftaleína é a que apresenta coloração rosa.
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
O propeno é muito mais reativo do que o eteno no que diz respeito à reação de hidratação catalisada por ácido.
A precipitação de cátions metálicos pela adição de um ânion com o qual eles formem composto insolúvel é uma ferramenta bastante utilizada para a remoção, identificação e(ou) quantificação de um metal em solução. Por exemplo, a adição de uma solução de H 2S é empregada para promover a precipitação de sulfetos metálicos pouco solúveis.
Considerando que as constantes de ionização ácida do H
2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
Em uma solução que contenha íons Cd2+ na concentração 1,0 × 10-5 mol/L, uma concentração de íons S2- igual a 1,0 × 10-20 mol/L será suficiente para iniciar a precipitação do CdS.
A tabela periódica e o modelo atômico evoluíram gradualmente ao longo do tempo, até as versões atuais. A figura precedente mostra uma ilustração bastante utilizada na representação de um átomo e que se baseia no modelo atômico de Bohr. Com relação à tabela periódica, aos modelos atômicos e aspectos a eles relacionados, julgue o próximo item.
A partir das localizações do selênio (Se) e do enxofre (S) na tabela periódica, é possível concluir que o ácido selenídrico (H2Se) possui acidez mais elevada do que o ácido sulfídrico (H2S).
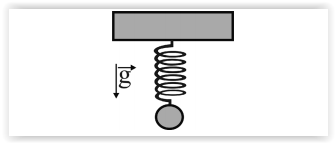
O sistema ilustrado na figura precedente mostra uma mola
de constante elástica igual 1 N/cm, a qual sustenta uma massa
de 100 g. Assumindo a aceleração da gravidade igual a 9,8 m/s2,
e 3,14 como o valor aproximado de π, julgue os itens seguintes.
Se a mola for cortada ao meio, o valor da sua constante elástica
dobrará.
Com o objetivo de avaliar o sistema de segurança de seus
produtos, uma indústria automobilística nacional submeteu um
automóvel de 900 kg de massa a um procedimento conhecido como
teste de impacto, constituído de duas fases: na primeira,
denominada arrancada, o automóvel é acelerado, por 10 s, partindo
do repouso até atingir a velocidade de 36 km/h; na segunda fase,
identificada como colisão, o veículo, ainda com a velocidade da
fase anterior, colide com um bloco de concreto não deformável e
para após 0,1 s, tendo sua estrutura sido danificada após o choque.
A partir dessa situação hipotética, julgue os itens a seguir,
considerando que o módulo da aceleração da gravidade
seja de 10 m/s2
No intervalo de 10 segundos iniciais, a força resultante média
sobre o automóvel foi superior a 1.000 N.
Acerca da mecânica newtoniana, julgue o item a seguir.
Embora as componentes de um vetor possam mudar quando se muda a origem do sistema de coordenadas, a segunda lei de Newton, escrita na forma vetorial, mantém exatamente a mesma forma.
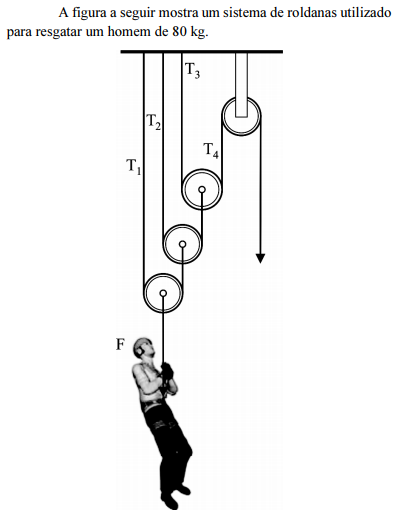
Considerando a figura, que as roldanas sejam ideais, os fios inextensíveis e que a gravidade local seja igual a 10 m/s2 , julgue o item a seguir.
Se a corda presa ao homem a ser resgatado se romper quando ele estiver a 3,2 m do solo, ele chegará ao solo com uma velocidade superior a 10 m/s.

O sistema ilustrado na figura precedente mostra uma mola
de constante elástica igual 1 N/cm, a qual sustenta uma massa
de 100 g. Assumindo a aceleração da gravidade igual a 9,8 m/s2,
e 3,14 como o valor aproximado de π, julgue os itens seguintes.
Para o corpo estar na sua posição de equilíbrio, a mola teve de
esticar um valor inferior a 1 cm.